СОДЕРЖАНИЕ ФЕНОЛЬНЫХ СОЕДИНЕНИЙ В ЛЕКАРСТВЕННЫХ РАСТЕНИЯХ БОТАНИЧЕСКОГО САДА
ИЗВЕСТИЯ РАН. СЕРИЯ БИОЛОГИЧЕСКАЯ № 5 2013
СОДЕРЖАНИЕ ФЕНОЛЬНЫХ СОЕДИНЕНИЙ 553
степени обладают лекарственными свойствами.
Из 708 видов ~300 широко распространенные.
Сбор остальных лекарственных растений в при
роде, в том числе 42 видов охраняемых растений,
может нанести значительный ущерб популяциям
и привести к их исчезновению (Соколов, 2004).
Фармакологическая ценность лекарственных
растений определяется количеством БАВ, их со
отношением и доминированием в химическом
составе растения тех или иных соединений.
Из числа изученных видов лекарственных рас
тений наиболее широко представлены сложно
цветные (11 видов), губоцветные (11 видов), лю
тиковые (6 видов), зонтичные (5 видов) и бурач
никовые (3 вида). Норичниковые, толстянковые,
кутровые, синюховые в общем насчитывали 8 ви
дов растений. Из 31 семейства изученных травя
Из 31 семейства изученных травя
нистых растений 22 представлены одним видом.
Фенольные соединения – один из наиболее
распространенных и многочисленных классов
природных соединений, обладающих биологиче
ской активностью. Образование фенолов – дина
мический процесс, в значительной степени зави
сящий от многочисленных факторов окружаю
щей среды. Главные из них – “стрессовый” и
возрастной факторы, а также фактор освещенно
сти (Мисин и др., 2010). Накопление фенольных
веществ в различных частях и органах растений
тесно связано с их функцией в жизнедеятельно
сти растений и фазой развития (Сажина, Мисин,
2011). Показано, что максимальное содержание
фенольных веществ наблюдается в середине лета,
в период цветения, и зависит от вида растения.
Так, например, основная часть полифенолов у ло
пуха большого сосредоточена в листьях и корнях,
у подорожника большого – в листьях и семенах, а
у кипрея – в бутонах и цветах (Мисин и др. , 2010).
, 2010).
Для анализа суммы фенольных веществ в лекар
ственных растениях использовались их листья
(табл. 1).
Наибольшее число фенольных соединений
было найдено (в порядке уменьшения) в листьях
синюхи голубой
Polemonium coeruleum
, герани
кровавокрасной
Geranium sanquineum
, мелиссы
лекарственной
Melissa officinalis
, чернокорня ле
карственного
Cynoglossum officinale
, шалфея клей
кого
Salvia glutinosa
, шлемника байкальского
Scutellaria baicalensis
, ревеня дланевидного
Rheum
palmatun
, шалфея лекарственного
Salvia officinalis
.
Суммарное содержание фенолов в этих растениях
составило 47.7–166.3 мг/г. Из восьми видов ле
карственных растений с максимальным содержа
нием фенольных веществ четыре вида входили в
семейство губоцветные Lamiaceae.
Достаточно высоким содержанием фенолов
отличались листья родиолы розовой, душицы
обыкновенной, монарды двойчатой, наперстян
ки крупноцветковой, медуницы лекарственной,
аралии сердцевидной, лука поникающего, васи
листника малого, лаванды узколистной, цикория
обыкновенного, полыни метельчатой, крово
хлебки лекарственной, пустырника пятилопаст
ного, подофилла эмоди, астранции крупной,
очитка большого. Эти растения оказались спо
Эти растения оказались спо
собными накапливать в листьях фенольные со
единения (от 21.8 до 42.3 мг/г). Для остальных ис
следованных видов лекарственных растений, ко
торых оказалось несравнимо больше (42),
средние уровни накопления фенолов были зна
чительно ниже 20 мг/г.
Основные и наиболее активные природные
антиоксиданты имеют фенольную природу. Су
щественный вклад в ССА лекарственных трав
вносят флавоноиды, дубильные вещества, оксиа
роматические кислоты, природные полифенолы,
витамины и др. При этом АОА веществ феноль
ного ряда может варьировать в широких преде
лах. Так, оценка АОА различных природных фла
воноидов показала, что наибольшей АОА после
теафлавина обладают кверцетин и цианидин.
Гликозиды кверцетина, например рутин, имеют
более низкую антиоксидантную активность, а
наименьшей АОА среди этой группы веществ ха
рактеризуются флавоны и флавонгликозиды
(RiceEvans
et al
. , 1997; Карпова и др., 2009). По
, 1997; Карпова и др., 2009). По
этому содержание водорастворимых низкомоле
кулярных антиоксидантов в растительном сырье –
важнейший показатель его биологической цен
ности, а результаты анализа суммарной АОА ле
карственных растений привлекают внимание
многих исследователей (табл. 2).
Как показывает анализ полученных данных,
максимальное суммарное содержание антиокси
дантов было характерно для листьев растений мя
ты перечной
Mentha piperita
, левзеи сафлоровид
ной
Rhaponticum carthamoides
, вероники длинно
листной
Veronica longifolia
, душицы обыкновенной
Origanum vulgare
, многоколосника фенхельного
Agastache foeniculum
, монарды двойчатой
Monarda
didyma
, герани кровавокрасной
G. sanquineum
.
Содержание АОА в этих растениях составило
4.2–14.8 мг/г. Из семи видов с максимальным со
держанием фенольных антиоксидантов пять отно
сились к семейству губоцветных Lamiaceae.
В листьях подофилла эмоди, лаконоса амери
канского, дрока красильного, расторопши пятни
стой, спаржи лекарственной, шалфея лекарствен
ного, кровохлебки лекарственной, алтея лекар
ственного, шлемника байкальского, окопника
лекарственного, бузины травянистой, зверобоя
обыкновенного, переступня двудомного, водо
сбора обыкновенного ССА в среднем было равно
0.94–2.9 мг/г. В листьях 45 видов лекарственных
растений (30 семейств) АОА находилась в более
низких пределах (0.05–0.83 мг/г).
Фенольные соединения — Добрая пчелка
Растительные фенольные соединения являются весьма распространенными биологически активными веществами растений, исследования которых ведутся уже более 100 лет. Из растений выделено несколько тысяч фенолов, и список их пополняется. Они представляют собой большой и разнообразный класс органических соединений. В отличие от весьма ядовитого фенола (карболовой кислоты) фенольные соединения растений не только малотоксичны, но и полезны. К производным фенола относятся дубильные вещества, кумарины, флавоноиды и их гликозиды и пр.
К производным фенола относятся дубильные вещества, кумарины, флавоноиды и их гликозиды и пр.
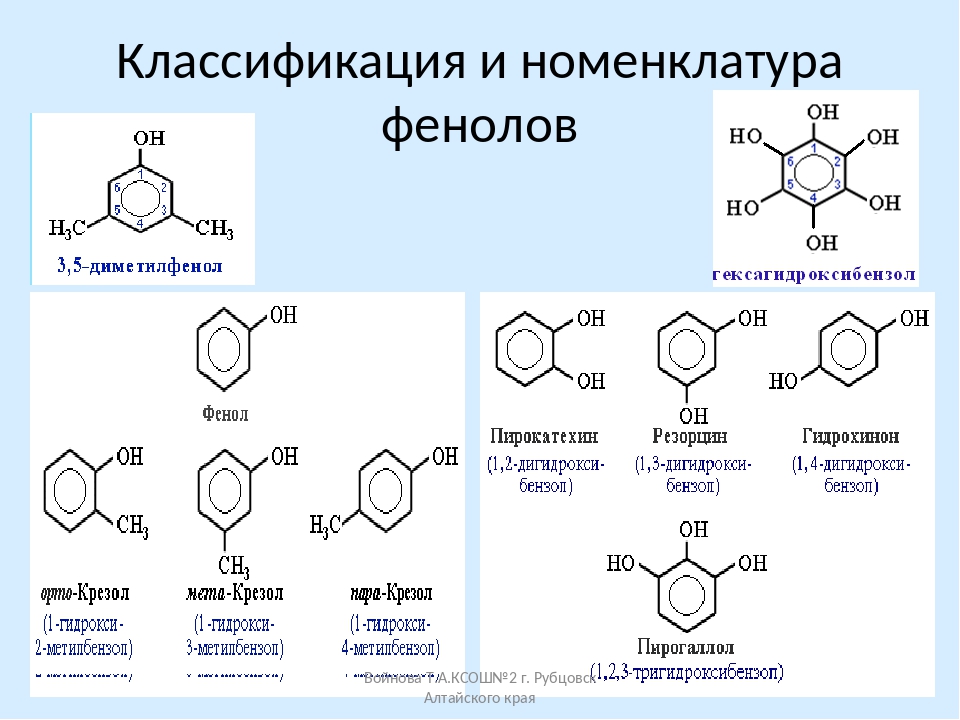
1. Флавоноиды (растительные пигменты или красители)
Флавоноиды относятся к фенольным соединениям с двумя ароматическими кольцами. Они встречаются как в свободном состоянии, так и в виде гликозидов, представляют собой растительные пигменты. В зависимости от структуры флавоноиды включают несколько групп (катехины, антоцианы, флавоны, флавонолы). Флавоноиды свое название получили от латинского слова «флавус»— желтый, так как первые выделенные из растений флавоноиды имели желтую окраску. Известно более 6500 флавоноидов.
Животные не способны синтезировать соединения флавоноидной группы. В настоящее время считается, что флавоноиды (наряду с другими растительными фенолами) являются незаменимыми компонентами пищи человека и других млекопитающих.
Особенно богаты флавоноидами высшие растения. Находятся флавоноиды в различных органах, но чаще в надземных: цветках, листьях, плодах. Наиболее богаты ими молодые цветки, незрелые плоды. Локализуются в клеточном соке в растворенном виде. Содержание флавоноидов в растениях различно: в среднем 0,5-5%, иногда достигает 20% (в цветках софоры японской).
Наиболее богаты ими молодые цветки, незрелые плоды. Локализуются в клеточном соке в растворенном виде. Содержание флавоноидов в растениях различно: в среднем 0,5-5%, иногда достигает 20% (в цветках софоры японской).
Во многих фруктах и ягодах флавоноиды более или менее равномерно распределены в кожице и мякоти. Поэтому слива, вишня, черника имеют ровную окраску. В противоположность этому, в плодах некоторых других растений флавоноиды содержатся, в основном, в кожице, и, в меньшей степени, — в мякоти. А в яблоках, например, они имеются только в кожице.
Функции флавоноидов в растениях мало изучены. Предполагается, что благодаря способности поглощать ультрафиолетовое излучение (330–350 нм) и часть видимых лучей (520–560 нм) флавоноиды защищают растительные ткани от избыточной радиации. Это подтверждается локализацией флавоноидов в эпидермальных (близких к поверхности) клетках растений. Окраска цветочных лепестков помогает насекомым находить нужные растения и тем самым способствовать опылению.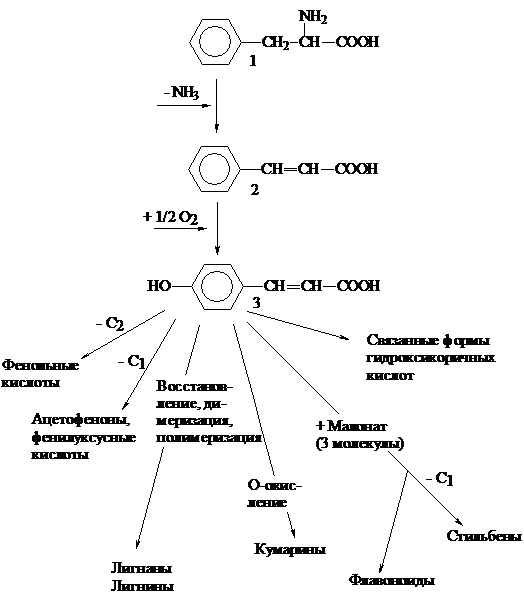 Входя в состав экстрактивных веществ древесины, флавоноиды способны придавать ей особую прочность и устойчивость к поражениям патогенными грибами. По-видимому, флавоноиды принимают участие в окислительно-восстановительных реакциях, протекающих в растительных тканях.
Входя в состав экстрактивных веществ древесины, флавоноиды способны придавать ей особую прочность и устойчивость к поражениям патогенными грибами. По-видимому, флавоноиды принимают участие в окислительно-восстановительных реакциях, протекающих в растительных тканях.
Значение флавоноидов для организма человека в качестве компонентов лекарственных растений изучено даже лучше, чем их функции в растениях. Началось все с того, что Сент-Дьердьи с группой ученых в 1936 году выделил чистый витамин С из венгерского перца — паприки. Вместе с витамином С он выделил вещество, способное уменьшить проявления авитаминоза С, которое он назвал витамином Р (от paprica – перец и permeability – проницаемость). Оказалось, что он способен уменьшать проницаемость стенки капилляров и хрупкость сосудов.
Основной функцией флавоноидов на настоящий момент считается антиоксидантная. Диапазон лечебных свойств растительного сырья, богатого флавоноидами, очень широк и не ограничивается только лишь их антиоксидантными свойствами.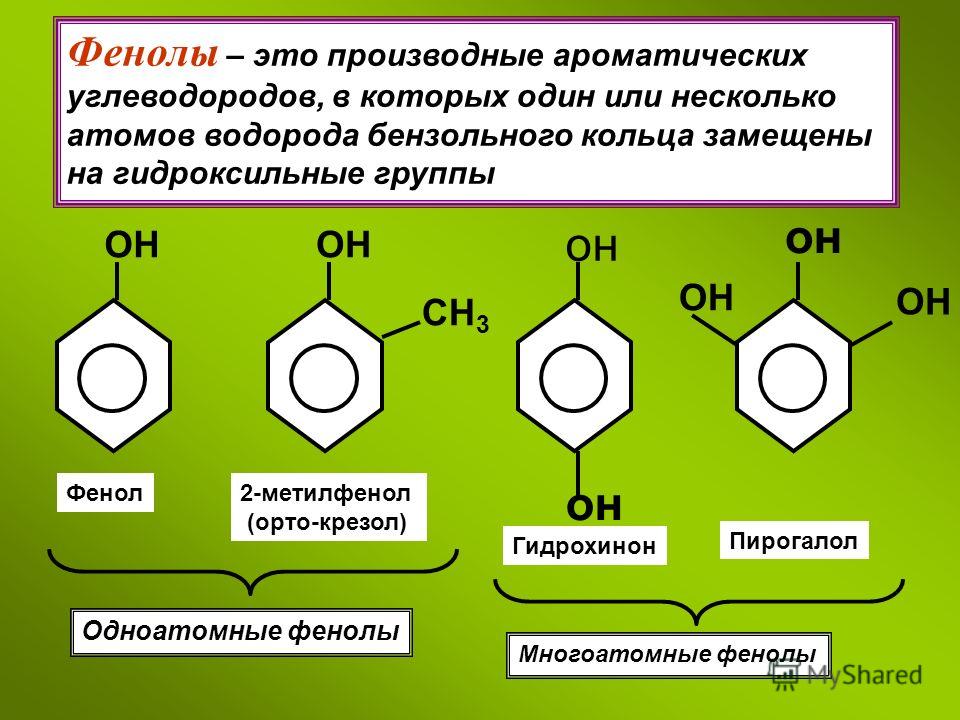 Многие флавоноиды уменьшают хрупкость капилляров, усиливают действие аскорбиновой кислоты. Витамин Р предохраняет аскорбиновую кислоту от окисления. Витамин С и витамин Р настолько тесно взаимодействуют, что витамин Р даже иногда называют витамином С2. Флавоноиды предохраняют от окисления и адреналин – один из главных гормонов организма. В зависимости от структуры флавоноиды также используются как противовоспалительное, противоязвенное, гипоазотемическое, радиопротекторное и другие средства. Некоторые обладают кровоостанавливающими свойствами; применяются при геморрое; служат хорошими желчегонными и диуретическими средствами, оказывают гипотензивное и седативное действие. Кроме этого флавоноиды благотворно влияют на сердце, желудок, предотвращают спазмы, препятствуют развитию аллергии, осуществляют регуляцию функции желез внутренней секреции. В последние годы появились сообщения о противоопухолевом действии флавоноидов. Они также способствуют поддержанию в хорошем состоянии коллагена, что препятствует образованию синяков, так как эластичность стенок сосудов как раз и зависит от качества коллагена.
Многие флавоноиды уменьшают хрупкость капилляров, усиливают действие аскорбиновой кислоты. Витамин Р предохраняет аскорбиновую кислоту от окисления. Витамин С и витамин Р настолько тесно взаимодействуют, что витамин Р даже иногда называют витамином С2. Флавоноиды предохраняют от окисления и адреналин – один из главных гормонов организма. В зависимости от структуры флавоноиды также используются как противовоспалительное, противоязвенное, гипоазотемическое, радиопротекторное и другие средства. Некоторые обладают кровоостанавливающими свойствами; применяются при геморрое; служат хорошими желчегонными и диуретическими средствами, оказывают гипотензивное и седативное действие. Кроме этого флавоноиды благотворно влияют на сердце, желудок, предотвращают спазмы, препятствуют развитию аллергии, осуществляют регуляцию функции желез внутренней секреции. В последние годы появились сообщения о противоопухолевом действии флавоноидов. Они также способствуют поддержанию в хорошем состоянии коллагена, что препятствует образованию синяков, так как эластичность стенок сосудов как раз и зависит от качества коллагена.
2. Хлорогеновые кислоты
Хлорогеновые (оксикоричные) кислоты относятся к фенольным соединениям с одним ароматическим кольцом. Оксикоричные кислоты встречаются практически у всех высших растений. Наиболее широко распространена кофейная кислота. Она часто образует димеры с алициклическими кислотами — хинной и шикимовой. Наиболее известны 3-кофеил-хинная кислота (хлорогеновая) и ее изомеры. Биологическая активность большинства оксикоричных кислот изучена пока недостаточно. Установлено выраженное желчегонное действие феруловой, кофейной, хлорогеновой кислот и особенно цинарина.
Отчет по IX Международному симпозиуму «Фенольные соединения: фундаментальные и прикладные аспекты»
В Федеральном государственном бюджетном учреждении науки Институте физиологии растений им. К.А. Тимирязева Российской академии наук (ИФР РАН) с 20 по 25 апреля 2015 г. проходил очередной IX Международный симпозиум «Фенольные соединения: фундаментальные и прикладные аспекты».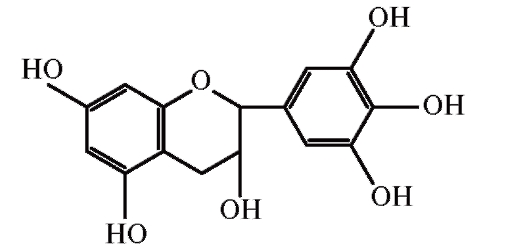
Общее же число участников симпозиума составило 450 человек, включая 100 докторов наук, 120 кандидатов наук, 150 научных сотрудников, 41 аспирант, а также магистранты и студенты из различных научно-исследовательских институтов, в том числе и Российской академии наук, а также высших учебных заведений и других организаций. Это были ведущие ученые и молодые исследователи, приехавшие из разных городов России и стран Ближнего и Дальнего зарубежья. Зарубежные государства — Италия (Милан), Финляндия (Турку), Белоруссия (Минск), Грузия (Батуми, Тбилиси), Казахстан (Астана, Алматы), Молдавия (Кишинев), Узбекистан (Ташкент). Российские исследователи — из Москвы, Санкт-Петербурга, Иркутска, Новосибирска, Саратова, Самары, Орла, Томска, Тулы, Вологды, Сыктывкара, Белгорода, Махачкалы, Уфы, Калининграда, Владивостока, Благовещенска, Екатеринбурга, Нижнего Новгорода, Хабаровска, Ярославля, Перми и других городов.
Это были ведущие ученые и молодые исследователи, приехавшие из разных городов России и стран Ближнего и Дальнего зарубежья. Зарубежные государства — Италия (Милан), Финляндия (Турку), Белоруссия (Минск), Грузия (Батуми, Тбилиси), Казахстан (Астана, Алматы), Молдавия (Кишинев), Узбекистан (Ташкент). Российские исследователи — из Москвы, Санкт-Петербурга, Иркутска, Новосибирска, Саратова, Самары, Орла, Томска, Тулы, Вологды, Сыктывкара, Белгорода, Махачкалы, Уфы, Калининграда, Владивостока, Благовещенска, Екатеринбурга, Нижнего Новгорода, Хабаровска, Ярославля, Перми и других городов.
Во время работы симпозиума было проведено одно пленарное заседание, 7 заседаний по главным направлениям в области фенольного метаболизма, Круглый стол «Современные направления в области изучения флавоноидных соединений» и две стендовые сессии. Секционные заседания затрагивали основные научные направления в этой важной биологической дисциплине, такие как «Фенольные соединения в высших растениях: образование и регуляция», «Фенольные соединения: свойства и структура», « Биологическая активность фенольных соединений и методы их исследования», «Медико-биологические и фармацевтические аспекты применения фенольных соединений», «Фенольные соединения: распространение, эффективность действия», «Растительные полифенолы и технологии на их основе», «Фенольные соединения высших растений и их функциональная роль».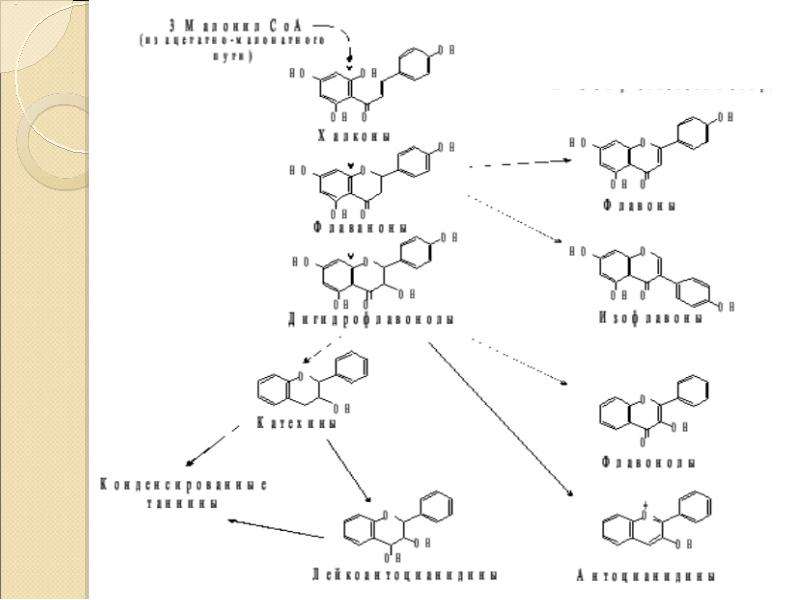
В настоящее время фенольные соединения высших растений (в средствах массовой информации они позиционируются как фенолы растительного происхождения, в том числе биофлавоноиды) привлекают пристальное внимание исследователей различного научного профиля – химиков, биологов, медиков, фармацевтов, пищевиков, технологов. Такой «комплексный» интерес ученых связан с разнообразной функциональной ролью этих соединений, а также все более широким практическим применением в медицине, фармакологии, пищевой промышленности. Кроме того, фенольным соединениям присуща высокая биологическая активность, которая обусловлена их химической структурой. Научные исследования последних лет показали перспективность поиска подходов для направленной регуляции биосинтеза этих представителей вторичного метаболизма в клетках высших растений, поскольку именно они в основном и являются продуцентами этих биологически активных веществ.
На пленарной сессии, открывшей работу симпозиума, было представлено три доклада. Проф. Загоскина Н.В. (Институт физиологии растений им. К.А. Тимирязева РАН, Москва) в своем выступлении «Фенольные соединения высших растений и их функциональная роль» рассмотрела вопросы образования и компартментации фенольных соединений в высших растениях, регуляции накопления этих вторичных метаболитов и их функциональной роли в клетках. Второй пленарный доклад «Регуляторная сеть биосинтеза флавоноидов (на примере пшеницы)» был сделан д.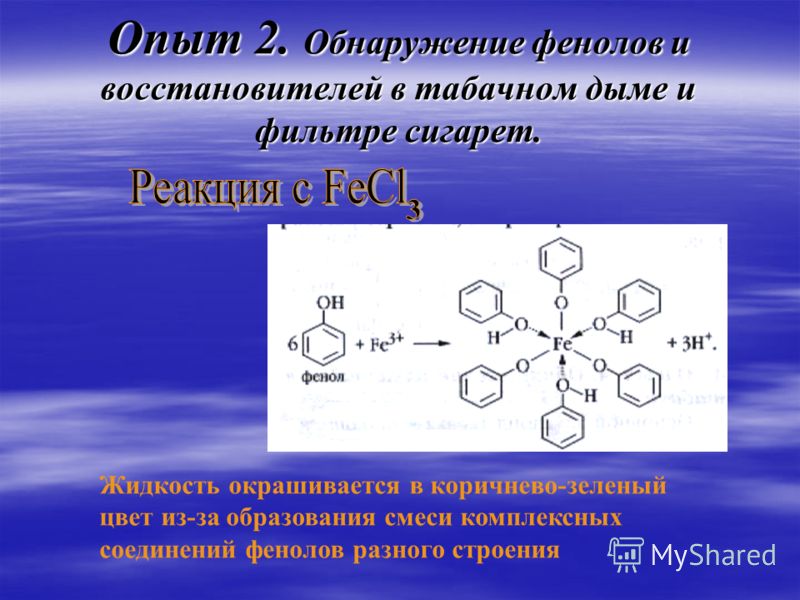
 Третий пленарный доклад «Фенольные соединения в стандартизации растительного сырья и лекарственных препаратов» был представлен проф. Куркиным В.А. (Самарский государственный медицинский университет) и имел физиолого-фармакологическую направленность. В настоящее время актуальность исследований по обоснованию целесообразности создания импортозамещающих антидепрессантных, ноотропных, анксиолитических, гепатопротекторных и иммуномодулирующих растительных препаратов, на основе использования лекарственных растений, содержащих фенилпропаноиды и флавоноиды, не вызывает сомнений. Важен поиск новых методических подходов к стандартизации лекарственного растительного сырья и фитопрепаратов, содержащих фенилпропаноиды, флавоноиды и антраценпроизводные, что и явилось предметом обсуждения. Стандартизация в методологии будет способствовать совершенствованию нормативной документации на лекарственное растительное сырье, содержащее фенольные соединения. И этот аспект практического применения полифенолов растительного происхождения является одним из перспективных направлений их промышленного использования.
Третий пленарный доклад «Фенольные соединения в стандартизации растительного сырья и лекарственных препаратов» был представлен проф. Куркиным В.А. (Самарский государственный медицинский университет) и имел физиолого-фармакологическую направленность. В настоящее время актуальность исследований по обоснованию целесообразности создания импортозамещающих антидепрессантных, ноотропных, анксиолитических, гепатопротекторных и иммуномодулирующих растительных препаратов, на основе использования лекарственных растений, содержащих фенилпропаноиды и флавоноиды, не вызывает сомнений. Важен поиск новых методических подходов к стандартизации лекарственного растительного сырья и фитопрепаратов, содержащих фенилпропаноиды, флавоноиды и антраценпроизводные, что и явилось предметом обсуждения. Стандартизация в методологии будет способствовать совершенствованию нормативной документации на лекарственное растительное сырье, содержащее фенольные соединения. И этот аспект практического применения полифенолов растительного происхождения является одним из перспективных направлений их промышленного использования.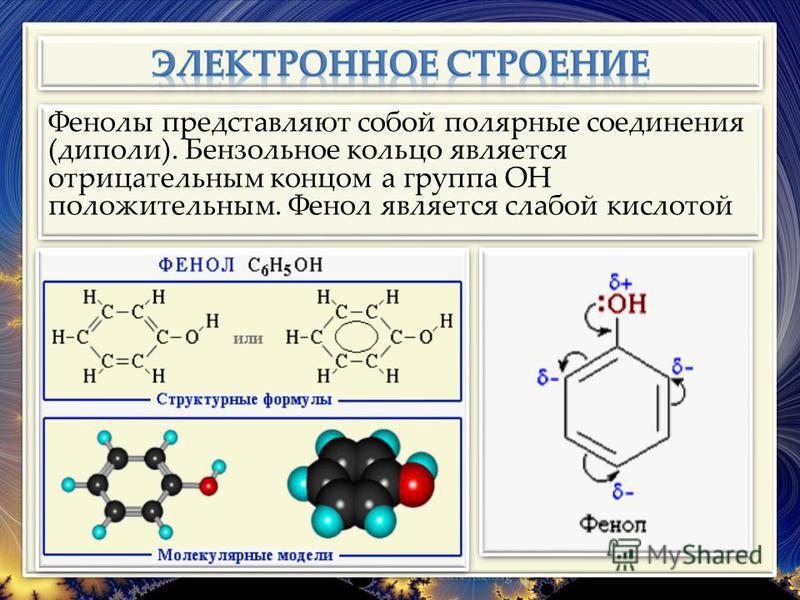
Далее работа симпозиума проходила по «традиционным» для этого научного мероприятия направлениям и включала доклады как ведущих специалистов, так и ученых, которые не столь давно начали свои исследования в этой области биологии. Так, с.н.с., к.б.н. Храмова Е.П. (Центральный сибирский ботанический сад СО РАН, Новосибирск) рассмотрела «Роль фенольных соединений в процессах адаптации Pentaphylloides fruticosa к условиям произрастания», отметила важную роль этих веществ, как протекторных и сигнальных соединений, отражающих адаптационную стратегию, выработанную естественным отбором растений в ходе эволюции. Доклад с.н.с., к.б.н. Ратькина А.В. (Институт общей генетики им. Н.И. Вавилова РАН, Москва) «Генетический контроль образования флавоноидных пигментов у высших растений» был посвящен рассмотрению вопросов по мутационной изменчивости состава флавоноидных пигментов, а также генетическому контролю их биосинтеза (на примере цветков горошка душистого). Д.б.н. Шугаев А.Г. (Институт физиологии растений им. К.А. Тимирязева РАН, Москва) в своем докладе «Салициловая кислота изменяет проницаемость внутренней мембраны митохондрий семядолей люпина» отметил, что салициловую кислоту (СК) относят к фитогормонам фенольной природы, которая оказывает регуляторное действие на многие физиологические процессы в растениях и вызывает большой интерес у исследователей и практиков. Рассмотрел вопросы влияния СК на проницаемость внутренней мембраны митохондрий люпина, которое, вероятно, является следствием открытия специального канала или поры, проницаемой для протонов и, возможно, для других низкомолекулярных катионов (К+, Са2+). При этом механизм действия СК на проницаемость внутренней мембраны митохондрий растений остается пока неизвестным и требует дополнительных исследований.
К.А. Тимирязева РАН, Москва) в своем докладе «Салициловая кислота изменяет проницаемость внутренней мембраны митохондрий семядолей люпина» отметил, что салициловую кислоту (СК) относят к фитогормонам фенольной природы, которая оказывает регуляторное действие на многие физиологические процессы в растениях и вызывает большой интерес у исследователей и практиков. Рассмотрел вопросы влияния СК на проницаемость внутренней мембраны митохондрий люпина, которое, вероятно, является следствием открытия специального канала или поры, проницаемой для протонов и, возможно, для других низкомолекулярных катионов (К+, Са2+). При этом механизм действия СК на проницаемость внутренней мембраны митохондрий растений остается пока неизвестным и требует дополнительных исследований.
В докладах сотрудников Института биохимической физики им. Н.М. Эмануэля РАН (Москва) – проф. Шишкина Л.Н., к.б.н. Алексеева О.М., к.ф-м.н. Кривандин А.В., представивших совместные с коллегами исследования, рассматривались вопросы реакционной способности фенольных соединений, их антиокислительной активности и действии в системах разной сложности. При этом каждый докладчик подчеркивал важную роль этих веществ и необходимость тщательного изучения их действия на различные биологические системы, что свидетельствует об «индивидуальности» и «эффективности» отдельных представителей полифенолов. В настоящее время большой интерес вызывают процессы «комлексообразования» полифенолов с другими соединениями. Этой теме был посвящен доклад к.х.н. Александровой В.А. и Домниной Н.С. (Институт нефтехимического синтеза им. А.В. Топчиева РАН, Москва; Санкт-Петербургский государственный университет, Санкт-Петербург) «Конъюгаты хитозана с фенольными антиоксидантами растительного происхождения: структура-свойства». Ими было установлено, что макромолекулярные антиоксиданты на основе хитозана и полифенолов растительного происхождения значительно превышают соответствующие показатели низкомолекулярных аналогов. Такой эффект достигнут при невысоком (1-3 масс.%) содержании вещества (поли)фенольного типа ковалентно связанного с макромолекулой. Включение галловой кислоты в боковую цепь хитозана дало возможность преодолеть известный недостаток галлатов – возможный двойственный характер действия (как защитный, так и сенсибилизирующий).
При этом каждый докладчик подчеркивал важную роль этих веществ и необходимость тщательного изучения их действия на различные биологические системы, что свидетельствует об «индивидуальности» и «эффективности» отдельных представителей полифенолов. В настоящее время большой интерес вызывают процессы «комлексообразования» полифенолов с другими соединениями. Этой теме был посвящен доклад к.х.н. Александровой В.А. и Домниной Н.С. (Институт нефтехимического синтеза им. А.В. Топчиева РАН, Москва; Санкт-Петербургский государственный университет, Санкт-Петербург) «Конъюгаты хитозана с фенольными антиоксидантами растительного происхождения: структура-свойства». Ими было установлено, что макромолекулярные антиоксиданты на основе хитозана и полифенолов растительного происхождения значительно превышают соответствующие показатели низкомолекулярных аналогов. Такой эффект достигнут при невысоком (1-3 масс.%) содержании вещества (поли)фенольного типа ковалентно связанного с макромолекулой. Включение галловой кислоты в боковую цепь хитозана дало возможность преодолеть известный недостаток галлатов – возможный двойственный характер действия (как защитный, так и сенсибилизирующий).
Следует также подчеркнуть, что несмотря на достаточно длительную историю изучения образования различных фенольных соединений в высших растениях – это направление до сих пор не теряет своего значения, что характерно для работ во всем мире. В значительной степени этот интерес является следствием поиска высоко-продукционных в отношении вторичных метаболитов видов, которые могут найти применение в качестве лекарственных средств. Интересные данные были представлены в докладах к.ф.н. Латыповой Г.М. с соавт. (Башкирский государственный медицинский университет, Уфа) «О фенольных соединениях представителей рода первоцвет (Primula L.)», к.ф.н. Кондратовой Ю.А. и проф. Бубенчиковой В.Н. (Курский государственный медицинский университет, Курск) «Фенольные соединения культивируемых и дикорастущих видов рода Salvia L.», к.б.н. Карповой Е.А. с соавт. (Центральный сибирский ботанический сад РАН, Новосибирск) «Перспективы исследования флавоноидов представителей рода Begonia L.» и проф. Маммадовым Р. С соавт. (Department of Biology, Faculty of Science and Literature; Department of Medical Biology, School of Medicine, Pamukkale University, Denizli, Turkey) «Antioxidant potentials, phenolic composition and antiproliferative activities of the different solvent extracts of cyclamen pseudibericum, endemic to Turkey». Во всех случаях были рассмотрены вопросы образования различных классов полифенолов у ряда представителей высших растений.
Фенольные соединения находят все более широкое применение в фармакологии и медицине. И в этом случае важно изучение как механизмов их действия, так и последствий от их применения. Эти вопросы рассматривались во многих докладах и вызывали большой интерес у участников симпозиума. И здесь в первую очередь можно отметить выступления сотрудников Первого Московского государственного медицинского университета им. И.М. Сеченова Минздрава России (Москва), которые под руководством проф. Тюкавкиной Н.А. уже многие годы занимаются этими вопросами. К их числу следует отнести доклад проф. Белобородова В.Л. с соавт. «Идентификация компонентов и анализ маркерных полифенолов мультиисточниковых фитопрепаратов простанорм и фито ново-сед», к.ф.н. Ильясова И.Р. с соавт. «Антиоксидантная активность бинарных композиций на базе диквертина», Шаманаева А.Ю. с соавт. «Фармакологическая активность композиций на основе дигидрокверцетина и арабиногалактана». Все они ярко продемонстрировали особенности и специфику действия различных полифенольных композиций. Очень интересный материал был представлен в докладе коллег из Научно-исследовательского института фармакологии и регенеративной медицины им. Е.Д. Гольдберга (Томск), который был доложен проф. Плотниковым М.Б. «Новые свойства и механизмы действия п-тирозола». В этом случае мы имели возможность услышать, как исследования, которые были начаты еще в 60-х годах прошлого столетия, в настоящее время с использованием современных технологий позволили выявить новые свойства п-тирозола при исследовании на моделях острой ишемии головного мозга с реперфузией и острой ишемии миокарда с реперфузией у крыс Вистар. Доклад д.х.н. Мишариной Т.А. с соавт. (Институт биохимической физики им. Н.М. Эмануэля РАН, Москва) «Действие малых доз фенол-содержащих эфирных масел на мышей» был посвящен изучению in vivo влияния малых доз этих вторичных веществ на продолжительность жизни, антиоксидантный и иммунный статус мышей. Впервые было установлено, что это масло обладало выраженным геропротекторным действием. Возможности использования полифенолов в медицине были также отражены в докладах Ерохина В.Н. с соавт. (Институт биохимической физики им. Н.М. Эмануэля РАН, Москва) «Фенольные растительные и синтетические антиоксиданты в профилактике злокачественных новообразований» и Кима Ю.А. с соавт. (Тульский государственный университет, Тула; Институт биофизики клетки РАН, Институт теоретической и экспериментальной биофизики РАН, Пущино) «Влияние флавоноидов на процесс фибриллообразования коллагена». Все это свидетельствует о важности изучения полифенолов растительного происхождения и возможностей их использования в фармакологии и медицине, которые до сих пор полностью не раскрыты.
Следует также отметить более широкое представление во время работы IX фенольного симпозиума материалов по применению этих вторичных метаболитов в промышленных целях. Этой теме был посвящен доклад проф. Кушнеровой Н.Ф. и Момот Т.В. (Тихоокеанский океанологический институт им. В.И. Ильичева ДВО РАН, Школа биомедицины Дальневосточного федерального университета, Владивосток) «Полифенольные комплексы из отходов от переработки ягодного сырья уссурийской тайги». Они показали, что отходы от переработки Дальневосточных дикоросов, таких как виноград амурский, лимонник китайский, аралия маньчжурская, калина Cаржента, жимолость съедобная, рябина амурская могут служить перспективным источником сырья для получения растительных фитопрепаратов, содержащих полифенольные комплексы с высоким содержанием биологически активных проантоцианидинов и антирадикальной активностью. В докладе проф. Дейнека В.И. с соавт. (НИУ Белгородский государственный университет, Белгород) «Фенольные соединения и качество фруктовых соков» продемонстрировано важное значение этих вторичных соединения для оценки качества соков, а в докладе проф. Яшина Я.И. с соавт. (ООО «Интерлаб», Москва) «Антиоксидантная активность специй и их влияние на здоровье человека» были представлены интересные данные по изучению состава специй и их антиоксидантной активности, что является новым в области полифенолов. Все эти доклады представляли собой прекрасное сочетание использования фундаментальных данных на практики.
Мы остановили внимание лишь на части докладов, прозвучавших на симпозиуме и вызвавших большой интерес у его участников. Устные сообщения и материалы постерных сессий были обсуждены на двух заседаниях, включая доклады по секционным направлениям. Поскольку научные данные, представленные во многих докладах IX Международного симпозиума по фенольным соединениям, явно носили ориентированный на практическое их использование характер, очень удачным и продуктивным было проведение Круглого стола «Современные направления в области изучения флавоноидных соединений». Обсуждение практических вопросов необходимо для ученых, которые хотят не только изучать различные вещества, их биологическую активность, но и искать подходы для понимания механизмов, ответственных за их биосинтез.
В заключении следует подчеркнуть, что IX Международный симпозиум «Фенольные соединения: фундаментальные и прикладные аспекты» еще раз продемонстрировал большой интерес ученых к этим веществам вторичного метаболизма, показал их важную и разнообразную роль в высших растениях и широкие возможности практического применения, в том числе в здравоохранении и пищевой промышленности. Кроме того, отмечен большой интерес исследователей к изучаемой проблеме, в том числе и молодых исследователей, число которых увеличивается, то есть кадровая тенденция имеет положительную динамику. Все участники отмечали «зависимость» исследований по изучению полифенолов от технической базы учреждений, которая в большинстве случаев требует модернизации, особенно в части высокоэффективной жидкостной хроматографии. Что касается научных проблем, стоящих перед исследователями, то они выполняются на современном уровне и соответствуют мировым тенденциям в области изучения фенольных соединений.
Проф., д.б.н Загоскина Н.В. (зав. группой фенольного метаболизма растений, Инстиутт физиологии растений им. К.А. Тимирязева РАН)
Проф., д. фарм. наук Куркин В.А. (зав. кафедрой фармакогнозии, Самарский государственный медицинский университет, Самара)
ИЗВЕСТИЯ ВУЗОВПрикладная химия и биотехнология
Данный сайт является архивным. Актуальный сайт журнала находится по адресу vuzbiochemi.elpub.ru
2016 / Номер 3 [ ФИЗИКО-ХИМИЧЕСКАЯ И ОБЩАЯ БИОЛОГИЯ ]
Цель данной работы — проанализировать и обобщить имеющуюся информацию о регуляторах роста растений, применяемых в агротехнике возделывания гречихи. Проанализированы открытия в области молекулярных основ гормональной регуляции растений, позволяющие углубить наши знания в вопросах механизмов действия их синтетических аналогов. Отмечено, что кроме фитогормонов к регуляторам роста относятся ряд фенольных соединений, обладающих биологической активностью, и ретарданты, являющиеся антагонистами гиббереллинов. Выявлена и обоснована необходимость разработки и рекомендации практического применения новых регуляторов роста. Использование регуляторов роста способствует уменьшению кратности обработки посевов фунгицидами в период вегетации и снижает норму их расхода на 25-50%. В результате анализа доказывается, что включение регуляторов роста в технологию возделывания гречихи является не только эффективным способом повышения ее продуктивности, но и важным резервом улучшения качества урожая и повышения устойчивости растительного организма к абиотическим и биотическим факторам внешней среды. Анализ результатов многочисленных исследований подтверждает необходимость применения регуляторов роста растений в технологии возделывания гречихи. Данный приём является не только эффективным способом повышения ее продуктивности, но и важным резервом улучшения качества урожая и повышения устойчивости растительного организма к абиотическим и биотическим факторам внешней среды.
Ключевые слова:
plant growth regulators,physiologically active substances,growth,development,buckwheat,sortspecification,phenolic compounds,регуляторы роста растений,физиологически активные вещества,рост,развитие,гречиха,сортоспецифичность,фенольные соединения,регуляторы роста растений,физиологически активные вещества,рост,развитие,гречиха,сортоспецифичность,фенольные соединения
Авторы:
- Мишина О.С.
- Белопухов С.Л.
- Ющенко Ю.А.
Библиографический список:
- Shapoval O.A., Vakulenko V.V., Mozharova I.Р., Lyubimova E.Yu. A new plant growth regulator — Surestim. Plodorodie [Fertility]. 2010, no. 4, рр.10-12. (in Russian)
- Shitilova T.I., Vitol I.S., Gerchiu Ya.Р., Belopukhov S.L., Semko V.T. The effects of drugs — phytoregulators on the formation of quality of grain crops. Dostizheniya nauki I tekhniki APK [Achievements of Science and Technology of AICis]. 2010, no. 12, рр. 47-48.
- Kawa J., Taylor C., Przybylski R. Urinary chiro-inositol and myo-inositol excretion is elevated in the diabetic db/db mouse and streptozotocin-diabetic rat. J. Agric. Food Chem. 2003, no. 1, рр. 56-61.
- Fesenko A.N., Shipulin O.A., Fesenko N.V. On selection the value of the morphogenesis of the reproductive shoots in areas of determinantal varieties of buckwheat. Agrarnaya nauka [Agrarian Science]. 2007, no. 4, рр.14-15. (in Russian)
- Ohsako T., Ohnishi O. New Fagopyrum species revealed by morphological and molecular analyses. Genes. Genet. Syst. 2001, vol. 73, рр. 85-94.
- Korotkov A.V., Prusakova L.D., Belopukhov S.L., Fesenko A.N., Tyurin S.A., Gritsevich Yu.G. The influence of surestime and bacteriorhodopsin on the yield and quality of buckwheat. Izvestiya TSKhA [Izvestiya of Timiryazev Agricultural Academy]. 2011, no. 1, pр. 118-123. (in Russian)
- Nefed’eva E.E., Lysak V.I., Belopukhov S.L. Pressure both external and internal factor affecting plants (a review). Izvestiya vuzov. Prikladnaya khimiya i biotekhnologiya [Proceedings of Higher School. Applied Chemistry and Biotechnology]. 2014, no. 6 (11), рр. 38-53. (in Russian)
- Belopukhov S.L., Safonov A.F., Dmitrevskaya I.I., Kocharov S.A. The influence of biostimulators on the chemical composition of the products of flax cultivation. Izvestiya TSKhA [Izvestiya of Timiryazev agricultural Academy]. 2010, no. 1, рр. 128-131. (in Russian)
- Bubich M., Maevski K., Shklyazh Ya. The effect of Mival and Krezatsin on morphological traits, yield of straw of grain, the protein its amino acid composition of the buckwheat grain (Fagopyrum esculentum Moench). Fagopyrum. 1990, no. 10, рр. 140-144. (in Japan)
- Kadyrov S.V., Kozlobaev A.V. Growth stimulant and chelated micronutrient fertilizers as the factor of increasing the yield of buckwheat. Vestnik Voronezhskogo gosudarstvennogo agrarnogo universiteta [Vestnik of Voronezh State Agrarian University]. 2011, no. 2, рр. 29-35. (in Russian)
- Koval’chuk N.S., Kulikova T.I., Prusakova L.D., Fesenko A.N. The effect of different bio-regulators on morphological parameters and structure of yield of buckwheat plants of different varieties. Agrokhimiya [Agricultural Chemistry]. 2006, no. 9, рр. 46-51. (in Russian)
- Spravochnik pestitsidov i agrokhimikatov, razreshennykh k primeneniyu na territorii Rossiiskoi Federatsii [Handbook of pesticides and agrochemicals permitted for use on the territory of the Russian Federation]. Moscow, Agrorus Publ., 2008, 400 p.
- Savel’eva N.A., Belova E.E., Kolontsov A.A., Korotchenkov D.A., Mishina O.S. The stability of buckwheat plants after the application of biostimulators of plants. Doklady Rossiiskoi Akademii sel’skokhozyaistvennykh nauk [Russian Agricultural Sciences]. 2014, no. 3, рр. 10-12. (in Russian)
- Belopukhov S.L., Blinnikova V.D., Volkov A.Yu. Investigation of elevated concentrations of heavy metal ions on germination of cereals and mustard. Doklady TSKhA [Reports of Timiryazev Agricultural Academy]. 2011, vol. 283, рр. 388-391. (in Russian)
- Shao Jian Zheng, Jian Li Yang, Yun Feng He [et al.] Immobilization of Aluminum with Phosphorus in Roots Is Associated with High Aluminum Resistance in Buckwheat. Plant Physiology. 2005, vol. 138, рр. 297-303.
- Belopukhov S.L., Grishina E.A. The study of the chemical composition and growth-stimulating action of extracts from humified flax fires. Izvestiya Vuzov. Prikladnaya Khimiya i Biotekhnologiya [Proceedings of Higher School. Applied Chemistry and Biotechnology]. 2012, no. 1 (2), рр. 97-103. (in Russian)
- Mishina O.S., Belopukhov S.L., Prusakova L.D. Physiological basis of application of regulators of growth Zircon and Carbitol to increase the productivity of buckwheat. Agrokhimiya [Agricultural Chemistry]. 2010, no. 1, рр. 42-54. (in Russian)
- Belopukhov S.L., Shatilova T.I., Gavrilina O.V., Vitol I.S., Karpilenko G.Р. The phytoregulator Larixin and indicators of quality of grain crops. Dostizheniya nauki I tekhniki APK [Achievements of Science and Technology of AICis], 2013, no. 9, рр. 34-35. (in Russian)
- Prusakova L.D., Malevannaya N.N., Belopukhov S.L., Vakulenko V.V. Zircon and cervical — bioregulators that affect the chemical composition and quality of grain buckwheat. Agrokhimiya [Agricultural Chemistry], 2005, no. 11, рр. 76-86. (in Russian)
- Mishina O.S., Prusakova L.D., Belopukhov S.L. The effect of processing of buckwheat by Zircon and Cervicolor on technological quality of grain. Butlerovskie soobshcheniya [Butlerov Communications], 2010, vol. 20, no. 5, рр. 62-66. (in Russian)
- Lakhanov A.Р., Glazova Z.I., Fesenko A.Р. Evaluation of the ecological plasticity and stability of grain formation in varieties of buckwheat. Doklady Rossiiskoi Akademii sel’skokhozyaistvennykh nauk [Russian Agricultural Sciences]. 2001, no. 1, pр. 6-7. (in Russian)
- Nefed’eva E.E., Belopukhov S.L., Verkhoturov V.V., Lysak V.I. The role of phytohormones in regulation of seed germination. Izvestiya vuzov. Prikladnaya khimiya i biotekhnologiya [Proceedings of Higher School. Applied Chemistry and Biotechnology]. 2013, no. 1, рр. 61-66. (in Russian)
- Prusakova L.D., Kefeli V.I., Belopukhov S.L., Vakulenko V.V., Kuznetsova S.A. The plant growth regulators with antistress and immune-protective properties. Agrokhimiya [Agricultural Chemistry]. 2008, no. 7, рр. 86-97. (in Russian)
- Prusakova L.D., Mishina O.S., Belopukhov S.L. The use of brassinosteroids in plants for extreme conditions. Agrokhimiya [Agricultural Chemistry]. 2013, no. 5, р.р. 45-50. (in Russian)
- Brunoni A., Vegyari G. Rutin content of the grain of buckwheat (Fagopyrum moench. and Fagopyrum tataricum gaerin.) varieties grown in southern Italy. Acta Agronomica Hungarica. 2007, vol. 55, no. 3, рр. 265-272.
- Prusakova L.D., Chizhova S.I. Role of phenolic compounds in plants. Agrokhimiya [Agricultural Chemistry]. 2005, no. 7, рр. 87-94. (in Russian)
- Ikeda S., Yamashita Y., Lin R., Kreft I. Nutritional-educational aspects of the utilization of buckwheat. Proc. 10-th Int. Symр. Buckwheat, 2007, рр. 478-482.
- Campbell, C.G. Buckwheat crop improvement. Fagopyrum. 2003, vol. 20, pр. 1-6.
- Шаповал О.А., Вакуленко В.В., Можарова И.П., Любимова Е.Ю. Новый регулятор роста растений — Люрастим // Плодородие. 2010. N 4. С. 10-12.
- Шитилова Т.И., Витол И.С., Герчиу Я.П., Белопухов С.Л., Семко В.Т. Действие препаратов — фиторегуляторов на формирование качества зерновых культур // Достижения науки и техники АПК. 2010. N 12. С. 47-48.
- Kawa J., Taylor C., Przybylski R. Urinary chiro-inositol and myo-inositol excretion is elevated in the diabetic db/db mouse and streptozotocin-diabetic rat // J. Agric. Food Chem. 2003. N 1. Р. 56-61.
- Фесенко А.Н., Шипулин О.А., Фесенко Н.В. О селекционном значении морфогенеза репродуктивной зоны побегов у детерминантных сортов гречихи // Аграрная наука. 2007. N 4. С. 14-15.
- Ohsako T., Ohnishi O. New Fagopyrum species revealed by morphological and molecular analyses // Genes Genet. Syst. 2001. Vol. 73. P. 85-94.
- Коротков А.В., Прусакова Л.Д., Белопухов С.Л., Фесенко А.Н., Тюрин С.А., Грицевич Ю.Г. Влияние люрастима и бактериородопсина на урожай и качество зерна гречихи // Известия ТСХА. 2011, Вып. 1. С 118-123.
- Нефедьева Е.Э., Лысак В.И., Белопухов С.Л. Давление как внешний и внутренний фактор, влияющий на растения (обзор) // Известия вузов. Прикладная химия и биотехнология. 2014. N 6 (11). С. 38-53.
- Белопухов С.Л., Сафонов А.Ф., Дмитревская И.И., Кочаров С.А. Влияние биостимуляторов на химический состав продукции льноводства // Известия ТСХА. 2010. Вып. 1. С. 128-131.
- Бубич М., Маевски К., Шкляж Я. Влияние мивала и крезацина на морфологические признаки, урожай соломы и зерна, а также содержание белка и его аминокислотный состав в зерне гречихи (Fagopyrum esculentum Moench) // Fagopyrum. 1990. Vol. 10. Р. 140-144.
- Кадыров С.В., Козлобаев А.В. Стимуляторы роста и хелатные микроудобрения как фактор повышения урожайности гречихи // Вестник Воронежского государственного аграрного университета. 2011. N 2. С. 29-35.
- Ковальчук Н.С., Куликова Т.И., Прусакова Л.Д., Фесенко А.Н. Влияние различных биорегуляторов на морфофизиологические показатели и структуру урожая растений гречихи разных сортов // Агрохимия. 2006. N 9. С. 46-51.
- Справочник пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации / Под ред. академика РАМН В.Н. Ракитского. М.: Изд-во Агрорус, 2008. 400 с.
- Савельева Н.А., Белова Е.Е., Колонцов А.А., Коротченков Д.А., Мишина О.С. Стабильность растений гречихи посевной после воздействия биостимуляторов растений // Доклады РАСХН. 2014. N 3. С. 10-12.
- Белопухов С.Л., Блинникова В.Д., Волков А.Ю. Исследование повышенных концентраций ионов тяжелых металлов на прорастание зерновых культур и горчицы // Доклады ТСХА. 2011, Вып. 283. С. 388-391.
- Shao Jian Zheng, Jian Li Yang, Yun Feng He. et al. Immobilization of Aluminum with Phosphorus in Roots Is Associated with High Aluminum Resistance in Buckwheat // Plant Physiology. Japan. 2005, Vol. 138. P. 297-303.
- Белопухов С.Л., Гришина Е.А. Исследование химического состава и ростстимулирующего действия экстрактов из гумифицированной льняной костры // Известия вузов. Прикладная химия и биотехнология. 2012. N 1 (2). С. 97-103.
- Мишина О.С., Белопухов С.Л., Прусакова Л.Д. Физиологические основы применения регуляторов роста Циркона и Карвитола для увеличения продуктивности гречихи // Агрохимия. 2010. N 1. С. 42-54.
- Белопухов С.Л., Шатилова Т.И., Гаврилина О.В., Витол И.С., Карпиленко Г.П. Фиторегулятор Лариксин и показатели качества зерновых культур // Достижения науки и техники АПК. 2013. N 9. С. 34-35.
- Прусакова Л.Д., Малеванная Н.Н., Белопухов С.Л., Вакуленко В.В. Регуляторы роста растений с антистрессовыми и иммунопротекторными свойствами // Агрохимия. 2005. N 11. С. 76-86.
- Мишина О.С., Прусакова Л.Д., Белопухов С.Л. Влияние обработок гречихи Цирконом и Карвитолом на технологические качества зерна // Бутлеровские сообщения. 2010. Т. 20, N 5. С. 62-66.
- Лаханов А.П. Глазова З.И., Фесенко А.П. Оценка экологической пластичности и стабильности формирования зерна у сортов гречихи // Доклады РАСХН. 2001. N 1. С. 6-7.
- Нефедьева Е.Э., Белопухов С.Л., Верхотуров В.В., Лысак В.И. Роль фитогормонов в регуляции прорастания семян // Известия вузов. Прикладная химия и биотехнология. 2013. N 1 (4). С. 61-66.
- Прусакова Л.Д., Кефели В.И., Белопухов С.Л., Вакуленко В.В., Кузнецова С.А. Роль фенольных соединений в растениях // Агрохимия. 2008. N 7. С. 86-97.
- Прусакова Л.Д., Мишина О.С., Белопухов С.Л. Циркон и карвитол — биорегуляторы, влияющие на химический состав и качество зерна гречихи // Агрохимия. 2013. N 5. С. 45-50.
- Brunoni A., Vegyari G. Rutin content of the grain of buckwheat (Fagopyrum moench. and Fagopyrum tataricum gaerin.) varieties grown in southern Italy // Acta Agronomica Hungarica. 2007. Vol. 55, N 3. P. 265-272.
- Прусакова Л.Д., Чижова С.И. Применение брассиностероидов в экстремальных для растений условиях // Агрохимия. 2005. N 7. С. 87-94.
- Ikeda S., Yamashita Y., Lin R., Kreft I. Nutritional-educational aspects of the utilization of buckwheat // Proc. 10th Int. Symр.р. Buckwheat. 2007. P. 478-482.
- Campbell, C.G. Buckwheat crop improvement // Fagopyrum. 2003. Vol. 20. Р. 1-6.
Файлы:
Фенольные соединения — биохимия виноделия
Страница 1 из 5
Глава 6
ФЕНОЛЬНЫЕ СОЕДИНЕНИЯ
Фенольные вещества широко распространены в растительном мире, они встречаются в самых различных органах растений.
Химическая природа фенольных соединений долго оставалась нераскрытой и только благодаря работам X. Фишера, К. Фрейденберга и П. Каррера удалось установить строение катехинов.
По химическому строению они весьма разнообразны, поэтому их трудно классифицировать.
К. Фрейнденберг делит фенольные вещества на две группы — гидролизируемые и конденсированные. К первой группе он относит гидролизирующие дубильные вещества, у которых бензольные ядра соединены в комплекс посредством атомов кислорода в форме сложных эфиров или гликозидных связей. Вторую группу составляют конденсированные фенольные соединения, у которых молекулы соединены одна с другой углеродными связями.
В настоящее время фенольные соединения делят на три группы по их углеродному скелету. К первой группе относятся простейшие фенольные соединения, имеющие общую формулу: С6—С1. К этим соединениям относятся фенольные кислоты: н-оксибензойная, протокатеховая, галловая, ванилиновая, салициловая, гентизиновая и др., а также соответствующие альдегиды и спирты.
Во вторую группу входят фенольные соединения со структурой С6—С3, они состоят из одного ароматического ядра и трехуглеродной боковой цепи, как показано ниже:
К ним относятся производные оксикоричной кислоты: n-оксикоричная, n-кумаровая, синаповая, кофейная, феруловая, а также соответствующие спирты. Относящиеся ко второй группе веществ фенольных соединений конифериловый, n-кумаровый и синаповый спирты образуют полимерные соединения типа лигнина.
К третьей группе относят фенольные соединения со структурой С6—С3—С6, имеющие следующее строение:
Это фенольное соединение состоит из двух ароматических ядер (А и В), соединенных между собой трехуглеродным фрагментом. (С). Эти соединения называют флавоноидами.
Третья группа наиболее распространенная. В зависимости от окисленности или восстановленности трехуглеродного фрагмента (С) получаются различные подгруппы фенольных соединений: катехины, лейкоантоцианы, флавононы, флавононолы, антоцианы, флавоны, флавонолы.
При обработке флавоноидов кислотами происходит конденсация и дальнейшее укрупнение молекул. Эти конденсированные соединения называют флобафенами.
Фенольные соединения — Справочник химика 21
Широкое использование нашли в сельском хозяйстве (растениеводстве, животноводстве, садоводстве) натриевые соли нефтяных кислот в качестве физиологически активных препаратов — нефтяных ростовых веществ. Применение 50—300 г препарата для обработки 1 га повышает урожайность зерновых, бобовых культур, ово щей, хлопчатника на 10—50% [141]. НРБ представляет собой 40 % раствор натриевых солей нефтяных кислот с кислотным числом 200—300 мг КОН/г. В НРВ кроме производных нефтяных кислот содержатся примеси серусодержащих, фенольных соединений, смол, [c.345]Фирмой Рои энд Хаас (США) разработан способ извлечения фенола и его производных адсорбцией на полимерном материале— сополимере стирола и дивинилбензола. Сточные воды, содержащие фенолы, пропускают через одну или несколько адсорбционных колонн, заполненных полимерной смолой. Очищенная вода содержит менее 0,0001% фенола. Адсорбционная емкость по фенолу зависит от природы и концентрации фенольных соединений, содержания солей и других органических примесей в сточной воде. [c.97] В качестве экспериментального подтверждения вышеприведенной реакции обрыва многими исследователями [6, 26, 27, 28,-33, 125] были предложены реакции между фенольными соединениями и свободными перекисными радикалами. [c.295]
Ранее описывался способ гидрогенизации дифенилолпропана над катализатором, состоящим из сульфида никеля, окисей хрома и алюминия, а также сульфидов меди, вольфрама и молибдена. Этот способ применим и для гидрогенизации смеси побочных продуктов. При 330 С исходную смесь (13 объемн. %), водород (47 объемн. %) и водяной пар (40 объемн. %) пропускают над катализатором. Гидрогенизат подвергают ректификации и получают 43% п-изопропилфенола, 40% фенола, 7,5% высококипящих фенольных соединений и 8,5% смолообразного остатка. [c.181]
Недавно с помощью специально разработанного колориметрического метода [42] определено содержание фенольных соединений в товарных автомобильных бензинах и их компонентах [43]. Показано [43], что содержание соединений типа фенолов в бензинах колеблется в значительных пределах. В бензинах каталитических процессов естественных антиокислителей содержится меньше, чем в бензинах термического крекинга. Сернокислотная очистка бензинов термического крекинга резко уменьшает содержание фенольных веществ. В бензинах прямой перегонки фенольные вещества отсутствуют. [c.226]
Обычно В бензинах очень мало нафтеновых кислот, их количество определяется кислотностью бензина. Кислотность бензина определяется по ГОСТ 5985—59 путем извлечения кислот из бензина кипящим этиловым спиртом и последующим титрованием спиртовым раствором едкого кали выражают его количеством КОН (в мг), необходимым для нейтрализации 100 мл бензина. Кислотность бензинов прямой перегонки и свежеполученных бензинов вторичного происхождения обычно не превышает 0,3—0,5 мг КОН/ЮО мл. Товарные автомобильные бензины при выпуске с завода могут иметь и более высокую кислотность (до 3 жг КОН/ЮО лг ) за счет кислых свойств антиокислителей фенольного типа, добавляемых для химической стабилизации бензинов. Однако коррозионная агрессивность фенолов, как правило, очень низкая, а некоторые из них являются хорошими ингибиторами коррозии. Кислотность бензинов, содержащих фенольные соединения, может иногда снижаться при хранении по мере расходования антиокислителя. [c.293]
Изучение кинетики окисления этилбензола в присутствии аминов и фенольных соединений [5] показало, что в процессе окисления концентрация амина в смеси остается постоянной вплоть до полного расходования фенола. Это, вероятно, связано с тем, что при окислении амина образуется свободный радикал, который отрывает атом водорода от молекулы фенола, давая новую молекулу амина вследствие этого концентрация амина практически не меняется до тех пор, пока не израсходуется весь фенол. [c.25]
Антидетонационный эффект воды можно усилить с помощью водорастворимых антидетонаторов, например фенольных соединений и соединений калия. [c.165]
Реакция изучалась аналогично алкилированию ароматических углеводородов (см. главу вторую) газообразными олефинами в приборе, представленном на рис. 12, и жидкими олефинами в приборе, представленном на рис. 13. В случае алкилирования фенолов после завершения реакции продукты обрабатывались водой с целью удаления катализатора, затем 5—10%-ным раствором щелочи до полного отделения фенольных соединений от эфирных (пока капля раствора, нанесенная на часовое стекло не давала мути с соляной кислотой), смесь обрабатывалась эфиром. Эфирный экстракт отделялся от щелочного, сушился хлористым кальцием и перегонялся. Из щелочного слоя путем обработки соляной кислотой выделялись алкилфенолы, сушились и фракционировались. При алкилировании алкилфениловых эфиров реакционная масса разбавлялась водой, нейтрализовалась содовым раствором, сушилась и перегонялась. Реакция изучалась при различных молярных отношениях реагентов, катализатора и температуре. В результате было показано, что алкилирование фенолов и алкил- [c.167]
Температура, С Время, часы эфирных соединений фенольных соединений всего [c.174]
Антиокислительные свойства фенолов зависят от их строения. Работами М. Д. Тиличеева, М. Б. Вольф и О. В. Васильевой (Плетневой), Н. М. Силищенской, И. П. Уварова и др. [67—71] установлено, что основными компонентами, обусловливающими максимальную эффективность антиокислителей фенольного типа, являются многоатомные фенолы и некоторые их диметиловые эфиры, в частности диметиловый эфир пирогаллола. Было показано, что антиокислительными свойствами в основном обладают фенолы с гидроксильными группами, расположенными рядом (о-диоксибензолы, пирокатехин, пирогаллол и их гомологи). Продукты, богатые фенольными соединениями различного строения, получают при термической переработке твердых горючих ископаемых. [c.234]
Циклогексиловый эфир о-хлорфенола является очень стойким и не изомеризуется при нагревании его в присутствии 25% эфирата фтористого бора в течение 8 час. при температуре 120 — 140° С. Этим, вероятно, и можно объяснить отсутствие в продуктах реакции фенольных соединений, которые обычно образуются путём изомеризации алкилфениловых эфиров. [c.210]
Из простейших фенольных соединений наибольшей активностью при стабилизации глубокоочищенных масел обладают р-нафтол, пирокатехин и пирогаллол, затем идут гидрохинон и резорцин. Наименьшей активностью из многоатомных фенолов обладает флороглюцин (табл. 2.15). Имеются данные [35, 96], свидетельствующие о высокой противоокислительной эффективности производных пирокатехина. Наиболее активными ингибиторами окисления в широком интервале температур оказались бис(3,4-дигидроксибензил)бензолы и бис(3,4-дигидрокси-фенил) алканы. [c.84]
В связи с этим появились исследования, целью которых было повысить чувствительность метода Коппешаара. Первая стадия (отгонка фенола с водяным паром) оставалась без изменения, а определение фенола в дистилляте бромит-броматным методом было заменено на фотоколориметрическое. Например, была использована цветная реакция фенола с 4-аминоантипирином , который является очень чувствительным реактивом на все фенольные соединения. По другому способу получали окрашенное соединение феноЛа с диметиламиноантипирином , которое образуется в щелочной среде в присутствии гексацианоферрата калия как окислителя. Фотоко-лориметрирование проводили в кювете 0 мм с синим светофильтром точность определения 10%. [c.194]
Исследованные бензины содержали практически одинаковое количество непредельных углеводородов (по йодному числу), но значительно различались по содержанию природных ингибиторов. Полученные результаты свидетельствуют о том, что эффективность фенбльных соединений, содержащихся в бензинах, чрезвычайно мала. Длительность индукционного периода окисления бензинов из туймазинской и бакинских нефтей составляет всего лишь 145—> 190 мин при значительном содержании фенольных соединений. Высокая эффективность фенольных соединений в бензинетермического крекинга эхабинского мазута, очевидно, обусловлена строением кислородных соединений эхабинской нефти. [c.227]
Аналогично гваякол и циклогексен в присутствии ВРз 0(С2Нб)2 дают смесь эфирных и фенольных соединений [60]. Обилий выход их и относительное содержание зависяг от температуры и времени реакции. Гваякол и циклогексен с ВРз-0(С2Н5)2 в молярных отношениях, равных 1 1 0,2, оставленные в течение 10 суток при комнатной температуре, не вступают в реакцию, а нагретые на кипяш ей водяной бане в течение 12 час. образуют циклогексиловые эфиры гваякола с выходом 58,3% и циклогексилгваякол с выходом 29,9% от теоретического. Таким образом, с увеличением времени нагревания выход фенольных продуктов значительно повышается, а эфирных немного снижается. [c.177]
Большое значение для окисления имеет также соотношение углеводородов разных классов, входящих в состав масел. Например, замечено, что присутствие определенного количества ароматических углеводородов в смеси парафинов и нафтенов приводит к автозамедлению процесса окисления за счет образования фенольных соединений из ароматических углеводородов. Вероятно, при этом конкурируют в основном два явления. Нафтеновые и парафиновые углеводороды превращаются в вещества, катализирующие окисление в результате происходят автокаталитические процессы. Ароматические углеводороды, наоборот, при окислении образуют вещества, стремящиеся задержать окисление нафтенов и парафинов, т. е. ароматические углеводороды приводят к замедлению окисления. Таким образом, автозамедление есть отрицательный катализ при помощи продуктов окисления, изменяющих ход реакции и уменьшающих скорость окисления. [c.15]
Пиросульфат активнее пиридинсульфотриоксида [32а], и так как он употребляется в ииридиновом растворе, то сначала, повидимому, образуется пиридиновый комплекс. Взаимодействие пиросульфата калия с фенольными соединениями относится к числу хорошо изученных реакций, тогда как соответствующих данных о прямом действии его на спирты недостаточно. В качестве этерифицирующего агента запатентован продукт присоединения серного ангидрида к азотистокислому натрию [326]. [c.12]
Многие сложные фенолы удалось метилировать в водном растворе или в растворе спиртовой щелочи [374]. В тех случаях, когда опасно применять сильную щелочь, можно употреблять раствор бикарбоната натрия [375]. Хорошо изучено [376] метилирование фенольных соединений в ксилоле. Установлено, что фенол и его гомологи не алкилируются диметилсульфатом в присутствии углекислого калия, но нитрофенолы алкилируются в этих условиях легче, чем в водном растворе. В случае галоиди-рованных фенолов получаются некоторые средние результаты междз результатами алкилирования фенола и его гомологов, с одной стороны, и нитрофенолов—с другой. Эти результаты находят объяснение с электронной точки зрения. Интересно знать, не происходит ли при метилировании разложение углекислого калия более кислыми фенолами с образованием легче алкилируемых калиевых солей. Попытки метилировать этим методом 2-окси-5-питробензойную кислоту и 2-окси-З-сульфо-бензойную кислоту привели [377] к отрицательным результатам даже при нагревании реакционной смеси в течение 2 месяцев. [c.66]
Действие щелочей на соли ароматических сульфокислот при высокой температуре изучено подробно вследствие большого технического значения и научного интереса, представляемого образующимися при этом фенолами. Хотя сам нол производится в настоящее время в значительной степени по другим методам, большая часть обычных фенольных соединений, включая нафтолы и их производные, все еще получается из сульфокислот. В применении этого метода синтеза фенолов все же встречаются известные ограничения. Присутствие гидроксильных и аминогрупп в орто- или лара-положении к сульфогруппе оказывает на последнюю глубокое влияние в смысле значительного уменьшения ев подвижности, а замещение такой сульфогруппы на гидроксил сопровождается перегруппировкой или полным распадом молекулы. Нитрогрунна тоже мешает образованию фенолов, так как действует в щелочном сплаве как окислитель и приводит к полному распаду нитросульфокислоты на аммиак, щавелевую кислоту и другие продукты [225]. Темпе менее в 2,4-динитробензолсульфо-кислоте активирующее влияние нитрогрупп так велико, что [c.229]
Наиболее легко в присутствии эфирата фтористого бора алкилируется олефинами сам фенол. Нри этом алкильные группы всегда направляются в орто- и пара-положения и практически не вступа-ют в мета-положение благодаря сильному ориентирующему влиянию группы ОН. При введении в ядро какого-либо заместителя реакционная способность фенола понижается, но степень такого понижения сильно зависит от природы заместителя и его положения в ядре.. Введение алкильных групп в ядро незначительно понижает реакционную способность фенола. Так, все три изомерных крезола сравнительно легко алкилируются олефинами и циклогексеном в нрисутствии фтористого бора с образованием смеси эфирных и фенольных соединений, нричвм, но даяным Ле-васа [52], циклогексеном лучше других алкилируется -крезол, хуже вступает в реакцию о-крезол и еще труднее п-крезол. Такое различие реакционной способности крезолов хорошо видно из данных табл. 101. [c.169]
Фенол и бутен-2 в присутствии ВРз-0(С2Н5)2 в молярном отношении 0,6 1 0,07 при температуре —10 до —5° С и в реме-ни 72 часа образуют смесь эфирных и фенольных соединений с общим выходом 81,3% от теоретического [53]. При комнатной [c.170]
У гваякола направляюш ий эффект группы ОСН3 конкурирует с ориентатом — группой ОН. Поэтому при взаимодействии его с олефинами образуется очень сложная смесь эфирных и фенольных соединений. Так, в случае алкилирования гваякола изобутиленом образуются приблизительно в равных количествах 4- и 5- [c.173]
Из приведеяньгх данных саидно, что о-крезол с циклогексеном в присутствии ВРз при 150° С образует только фенольные соединения. В их состав входят 2-метил-б-циклогексилфенол, 2-метил-4-циклогексилфенол и (вероятно) дициклогексил-о-крезол. [c.176]
В присутствии катализатора ВРз-0(С2Н5)2 при температуре кипящей водяной бани пол ается тоже смесь эфирных и фенольных соединений. Но соединение ВРз-0(С2Н5)г является более мягким катализатором, чем свободный ВРз, поэтому даже прп этой температуре основными продуктами реакции являются эфирные соединения. Например, при нагревании на кипящей водяной бане в течение 4,5 час. о-крезола, циклогексена и ВРз 0(С2Н5)2 в молярных отношениях, равных 1 1 0,05, получаются цпкло-гексиловый эфир о-крезола и циклогексил-о-крезол с выходом соответственно 41,4 и 5% [59]. [c.176]
Характерно, что в изученных условиях единственным фенольным соединением является п-циклогексилгваякол. Циклогекси-ловых эфиров гваякола получается два — жидкий и кристаллический в относительных количествах 30—32 и 68-70% соответственно. Кроме того, из неперегоняющегося остатка продуктов реакции, полученных при нагревании смеси в течение 12 час., выделен более сложный продукт в виде красивых серого цвета игольчатых кристаллов. Состав и строение его не установлены. [c.177]
Алкилирование г-хлорфенола бутеном-2 и пентеном-2 в присутствии ВГз 0(С2Н5)2 изучено при температуре 95—97° С и молярных отношениях реагентов и катализатора, равных 0,5— 2 1 0,1—0,36. Для каждого опыта брались 0,1 моля га-хлорфено-ла и соответствующие количества олефина и катализатора. /г-Хлор-фенол с указанными олефинами образует смесь эфирных и фенольных соединений. Эфирные продукты в данной реакции явля- [c.210]
Введение в радиационную химию (1963) — [ c.200 , c.201 ]
Методы аналитической химии Часть 2 (0) — [ c.414 ]
Природные средства защиты растений от вредителей (1986) — [ c.15 , c.82 , c.84 , c.102 , c.108 , c.129 , c.129 , c.150 , c.150 , c.157 ]
Особенности брожения и производства (2006) — [ c.150 , c.509 ]
Хроматография Практическое приложение метода Часть 2 (1986) — [ c.242 ]
Методы аналитической химии — количественный анализ неорганических соединений (1965) — [ c.339 ]
Жизнь зеленого растения (1983) — [ c.59 , c.157 , c.395 ]
ИЗУЧЕНИЕ ВОЗМОЖНОСТИ ПРИМЕНЕНИЯ РАСТИТЕЛЬНЫХ ФЕНОЛЬНЫХ СОЕДИНЕНИЙ ДЛЯ ПРЕДОТВРАЩЕНИЯ ПОРЧИ МЯСНЫХ ПРДУКТОВ | Опубликовать статью ВАК, elibrary (НЭБ)
ИЗУЧЕНИЕ ВОЗМОЖНОСТИ ПРИМЕНЕНИЯ РАСТИТЕЛЬНЫХ ФЕНОЛЬНЫХ СОЕДИНЕНИЙ ДЛЯ ПРЕДОТВРАЩЕНИЯ ПОРЧИ МЯСНЫХ ПРДУКТОВ
Научная статья
Икрами М.Б.1, *, Тураева Г.Н.2, Шарипова М.Б.3
1, 2, 3 Технологический университет Таджикистана, Душанбе, Республика Таджикистан
* Корреспондирующий автор (mavzuna-83[at]mail.ru)
Аннотация
В статье рассмотрены результаты исследований антиоксидантной активности водных экстрактов, полученных из различных частей растений семейства яснотковых (губоцветных) – мяты полевой, мяты садовой, мелиссы лекарственной, базилика фиолетового. Было выявлено, что водные экстракты из растений семейства яснотковых – мяты полевой и садовой, базилика фиолетового и мелиссы лекарственной, можно применять как безопасные антиоксиданты в технологии растительных масел и жиросодержащих продуктов, таких как мясной фарш. Показано, что наибольшей антиоксидантной активностью обладают экстракты из базилика фиолетового, наименьшей – экстракты мяты садовой. Также было изучено влияние на сохранность мяса количества растительных экстрактов.
Экстракты из растений семейства яснотковых, содержащие фенольные соединения различных классов по своей антиоксидантной активности не уступают синтетическим антиоксидантам. Проведенные исследования по изучению возможности применения экстрактов из некоторых растений семейства яснотковых в качестве антиоксидантов для жиров и жиросодержащих продуктов, показывают, что указанные экстракты можно использовать для предотвращения или замедления окислительных процессов, приводящих к снижению пищевой ценности и срока хранения продовольственных продуктов.
Ключевые слова: антиоксиданты, экстракты, мяты полевой, мяты садовой, мелисса, мясной фарш.
STUDYING POSSIBILITY OF USING VEGETABLE PHENOLIC COMPOUNDS TO PREVENT DAMAGE TO MEAT PRODUCTS
Research article
Ikrami M.B.1, *, Turaeva G.N.2, Sharipova M.B.3
1, 2, 3 Technological University of Tajikistan, Dushanbe, Republic of Tajikistan
* Corresponding author (mavzuna-83[at]mail.ru)
Abstract
The paper discusses the results of studies of the antioxidant activity of water extracts obtained from various parts of the plants of the family of Lamiaceae (Labiaceae) – field mint, garden mint, lemon balm, purple basil. It was found that water extracts from plants of the family Lamiaceae – field and garden mint, violet basil, and lemon balm can be used as safe antioxidants in the technology of vegetable oils and fat-containing products, such as minced meat. It was shown that the extracts from violet basil have the highest antioxidant activity, and the extracts of garden mint have the least activity. The effect of the number of plant extracts on meat safety was also studied.
The extracts from plants of the Lamiaceae family containing phenolic compounds of various classes are not inferior to synthetic antioxidants in their antioxidant activity. Studies conducted on the feasibility of using extracts from some plants of the family of Lamiaceae as antioxidants for fats and fat-containing products show that these extracts can be used to prevent or slow down oxidative processes, leading to a decrease in nutritional value and shelf life of food products.
Keywords: antioxidants, extracts, field mint, garden mint, lemon balm, minced meat.
Введение
Проблема увеличения сроков хранения скоропортящихся мясных продуктов – одна из актуальных в мясоперерабатывающей промышленности.
Причинами порчи мяса является дезаминирование аминокислот (прямого, восстановительного, окислительного, гидролитического) при гниении мяса, а также жизнедеятельность остаточной микрофлоры, при которой могут окисляться и гидролизоваться жиры. Окисление и гидролиз жиров могут происходить также под воздействием кислорода и влаги воздуха. При этом не только значительно ухудшаются органолептические свойства мясных продуктов – вкус, цвет и аромат, обуславливающие его потребительские качества и сокращается срок хранения. Накапливающиеся в результате окислительных процессов первичные и вторичные продукты окисления (пероксиды и гидропероксиды, свободные жирные кислоты, альдегиды и кетоны, амины) снижают пищевую ценность продуктов за счет изменения химического состава, а нередко и из-за своей токсичности. Как показал анализ существующей литературы, одним из путей решения этой проблемы является применение антиоксидантов природного происхождения на основе растительного сырья. Это направление весьма актуально, так как помимо основной задачи – увеличения сроков хранения продукции при сохранении всех потребительских качеств, повышается его биологическая ценность за счет содержащихся в растительных экстрактах витаминов, эфирных масел, флавоноидов, катехинов и других фенольных веществ [1], [2], [3]. Необходимо учитывать так же то, что в процессе эволюции организм человека адаптировался к природным соединениям, к их соотношению и поэтому пищевые добавки природного происхождения, в том числе антиоксиданты, оказывают более мягкое физиологическое действие на организм, чем синтетические добавки.
Методы и объект исследования
Нами было изучена возможность применения экстрактов из мяты полевой мяты садовой, базилика фиолетового и мелиссы лекарственной в качестве антиоксидантов в технологии мясных продуктов. Опытными образцами при изучении влияния растительных экстрактов на сохранность мяса, служил фарш из говядины, в который вводились растительные экстракты в количестве 1 % от массы образца мясного фарша. Порча образцов определялась по органолептическим показателям, по содержанию летучих жирных кислот, которые образуются в мясе в результате химического и микробиологического дезаминирования белков, а также по кислотному числу, которое изменяется вследствие окислительных и гидролитических процессов жировой составляющей мяса. В образцах фарша с экстрактами и в контрольном образце непосредственно после внесения экстрактов определялись органолептические показатели, содержание летучих кислот, кислотное число. Затем эти определения проводились в образцах фарша через 5, 10, 15 дней после внесения экстрактов. В промежутках между определениями образцы хранились в холодильнике при температуре 4-80С.
В органолептическом методе порча мяса определяется по внешнему виду, консистенции, запаху, состоянию мышц и жира. По показателям этих свойств мясо и мясная продукция разделяется на свежее, сомнительной свежести и несвежее [4].
Результаты органолептического анализа показали, что в контрольном образце мясного фарша на пятые сутки хранения появляются признаки, характерные для категории «сомнительной свежести», что свидетельствует о начавшейся окислительной порче образца. Эти признаки усиливаются к 10 дню хранения. К концу срока эксперимента, окислительный процесс в образце приводит к значительной его порче. В опытных образцах окислительная порча проявляется позже – через пять дней хранения показатели качества мяса соответствуют норме. Первые признаки окислительной порчи проявляются к десятому дню хранения. К концу эксперимента опытные образцы соответствуют категории «сомнительной свежести».
С результатами органолептического анализа согласуются данные по определению содержания летучих жирных кислот, и кислотного числа в контрольных и опытных образцах (таблицы 1-2).
Таблица 1 – Содержание летучих жирных кислот в контрольном и опытных образцах
| № | Экстракт | Количество летучих кислот в образцах мясного фарша, мг/100 г | |||
| При внесении экстракта | 5 дней | 10 дней | 15 дней | ||
| 1 | Без экстракта | 2,25 | 4,35 | 6,5 | 9,8 |
| 2 | Мяты полевой | 2,21 | 2,54 | 3,58 | 4,6 |
| 3 | Мяты садовой | 2,23 | 3,27 | 4,00 | 5,6 |
| 4 | Базилика фиолетового | 2,20 | 2,25 | 2,85 | 4,40 |
| 5 | Мелиссы лекарственной | 2,20 | 3,10 | 3,30 | 5,23 |
В соответствии с полученными результатами, в контрольных и опытных образцах мяса при хранении при температуре 5-80С в течение 15 дней содержание летучих жирных кислот постепенно увеличивается и составляет в контрольном образце 9,8 мг КОН на 100 г образца, в опытных образцах, содержащих растительные экстракты – от 4,4 до 5,6 мг/100г. Сравнение значений содержания летучих кислот в контрольных и опытных образцах показывает, что после хранения в течение 15 суток содержание летучих жирных кислот в контрольном образце свидетельствует о порче образца, а в образцах с исследуемыми экстрактами соответствует нормам сомнительной свежести [5].
Значения кислотного числа исследуемых образцов (таблица 2) также подтверждают замедление появления признаков окислительных процессов в опытных образцах по сравнению к контролем.
Таблица 2 – Значения кислотного числа образцов в зависимости от времени хранения
| № | Экстракт | Кислотное число образцов, мг/100 г | |||
| При внесении экстракта | 5 дней | 10 дней | 15 дней | ||
| 1 | Без экстракта | 0,80 | 1,40 | 2,25 | 3,00 |
| 2 | Мяты полевой | 0,80 | 1,10 | 1,60 | 2,20 |
| 3 | Мяты садовой | 0,80 | 1,25 | 1,85 | 2,60 |
| 4 | Базилика фиолетового | 0,80 | 0,90 | 1,10 | 1,80 |
| 5 | Мелиссы лекарственной | 0,80 | 1,00 | 1,38 | 2,00 |
Было также изучено влияние на сохранность мяса количества растительных экстрактов. Для этого в образцы мясного фарша вводились экстракты из вышеперечисленных растений в количестве 0,5%, 1% и 5% от массы фарша. В контрольном (без экстракта) и опытных образцах мясного фарша определялось содержание летучих кислот непосредственно после внесения экстрактов и через 15 дней после хранения образцов в холодильнике при температуре 5-80С. Полученные результаты представлены в таблице 3.
Таблица 3 – Содержание летучих кислот в образцах мясного фарша с различным количеством экстракта после хранения в течение 15 дней
| № | Экстракт | Содержание экстракта в мясном фарше, мг/100 г | ||
| 0,5% | 1,0% | 5,0% | ||
| 1 | Без экстракта | 9,74 | 9,68 | 9.54 |
| 2 | Мята полевая | 4,45 | 4,56 | 4,75 |
| 3 | Мята садовая | 5,21 | 5,78 | 6,43 |
| 4 | Базилик фиолетовый | 4,10 | 4,84 | 4,67 |
| 5 | Мелисса лекарственная | 4,93 | 5,25 | 5,65 |
Результаты приведенных экспериментов показали, что введение в образцы мясного фарша растительных экстрактов из мяты полевой, мяты садовой, базилика фиолетового и мелиссы лекарственной в исследуемых образцах мясного фарша во всех выбранных дозировках изменяет содержание летучих кислот. Значения показателей кислотного числа в образцах при различных дозировках отличаются незначительно и во всех случаях находятся в пределах допустимых норм. Одновременно определялись органолептические показатели исследуемых образцов, которые согласуются с содержанием летучих кислот в исследованных образцах.
Заключение
Таким образом, проведенные исследования позволяют считать, что исследуемые растительные экстракты задерживают порчу мяса. Увеличение срока хранения такого нестойкого продукта, как мясной фарш, срок хранения которого по ГОСТу составляет при температуре 1-60С 1 сутки (24 часа), при введении исследуемых растительных экстрактов составляет примерно 5 суток.
Также выявлено, что наибольшее замедление окислительных процессов вызывает экстракт базилика – и содержание летучих кислот, и кислотное число за 1 суток хранения образцов. Из всех исследованных экстрактов несколько слабее антиоксидантное воздействие экстракта мяты садовой.
Таким образом, проведенные исследования по изучению возможности применения экстрактов из некоторых растений семейства яснотковых в качестве антиоксидантов для жиров и жиросодержащих продуктов, показывают, что указанные экстракты можно использовать для предотвращения или замедления окислительных процессов, приводящих снижению пищевой ценности и срока хранения продовольственных продуктов. Сравнение антиоксидантной активности исследованных экстрактов с известными из литературы наиболее часто применяемыми антиоксидантами синтетического происхождения, например с ионолом, оксибутиланизолом или бутилокситолуолом (ионолом) показывает, что по своему действию экстракты из растений семейства яснотковых, содержащие фенольные соединения различных классов, не уступают синтетическим антиоксидантам. Например, бутилокситолуол уменьшает значение перекисного числа растительных масел через 14 суток хранения в 1,38 раз [6], исследованные нами экстракты мяты садовой и полевой, базилика и мелиссы – от 1,58 до 2,5 раз. По данным авторов [6], [7] экстракт из мяты перечной снижает перекисное число подсолнечного масла по сравнению с контрольным образцом в 2,1 раз, а экстракт индийского базилика – в 1,92 раза. Значения аналогичных показателей для исследованных нами экстрактов вполне сопоставимы с этими данными. Небольшие различия в значениях антиоксидантой активности вероятно связаны с видовой принадлежностью и условиями произрастания исследованных растений. Вместе с тем, растительные экстракты не оказывают токсического действия на организм человека, и их применение не требует гигиенического нормирования, как синтетические антиоксиданты [8]. Немаловажным является тот факт, что фенольные соединения, которые составляют доминирующую группу химических природных соединений в составе исследованных экстрактов, считаются функциональным элементом и продукты питания, содержащие их, относятся к продуктам с функциональными свойствами.
В связи с вышесказанным, водные экстракты из растений семейства яснотковых – мяты полевой и садовой, базилика фиолетового и мелиссы лекарственной, можно считать эффективными и экологически безопасными антиоксидантами и рекомендовать их применение в технологии растительных масел и жиросодержащих продуктов различных групп.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References Список литературы на английском языке / References in English
| Фенольные кислоты | Гидроксикоричные кислоты Кофейная кислота Хлорогеновая кислота Феруловая кислота Синапиновая кислота Кафтаровая кислота Неохлорогеновая кислота | ягодная -Ягода клубничная | 9 -000 , черная смородина, черника, клюква, груша, черешня, яблоко, апельсин, грейпфрут, лимон и персик | [8] |
| Гидроксибензойная кислота Эллаговая кислота Галловая кислота | Клубника, малина, виноград семя и гранат | [8,9] | ||
| Флавоноиды | Флавонолы Мирицетин Кверцетин Кемпферол Изорамнетин | Яблоки, абрикосы, черника, черника, ягоды, ягоды , ежевика и черника | [10] | |
| Флаваноны 9000 8 Нарингенин Гесперетин | Лимон, апельсин, грейпфрут и мандарин | [11,12] | ||
| Флавоны Апигенин Лютеолин Тангеретин Нобилетин | ||||
| Флаван-3-ол (+) — Катехин (-) — Эпикатехин (-) — Эпикатехин 3-галлат (-) — Эпигаллокатехин-3- галлат (+) — Галлокат (+) — Галлокат (+) — Галлокатехин (+) — Галлатехин (-) (-) — Эпигаллокатехин Процианидины Продельфинидины | Яблоки, абрикосы, виноград, персики, нектарины, малина, вишня, ежевика, черника, клюква, груши, сливы и изюм | [14] | 9006 Цианидин-3-галактозидЕжевика, черная смородина, черника, черный виноград, бузина малина, клубника, вишня, сливы, клюква, гранат и малина | [15] |
| Дигидрохалконы Флоретин Флоридзин | Яблоко | [16] | ||
| Виноград | [17] | |||
| Танины | Катехиновые полимеры Эпикатехиновые полимеры Эллагитаннины Проантоцианидины Дубильные кислоты | Яблочный сок, клубника, грецкие орехи, малина и слива | [18] | |
| Лигнаны | Секоизоларицирезинол Матайрезинол | Груша | [19] |
Фенольные соединения: из растений в пищевые продукты
Absal Iara и др. (2011) Новые стратегии изучения химической природы винных олигомерных процианидинов.Anal Bioanal Chem 401: 1485–1495PubMed Google ученый
Agrawal PK (1989) ЯМР углерода-13 флавоноидов. Эльзевир, Амстердам
Google ученый
Anastasiadi M, Zira A, Magiatis P et al (2009) 1 Метабономика на основе H ЯМР для классификации греческих вин по сортам, региону и урожаю. Сравнение с данными ВЭЖХ. J Agric Food Chem 57: 11067–11074
PubMed CAS Google ученый
Андерсен О., Маркхэм К. (2006) Флавоноиды: химия, биохимия и приложения.CRC Press, Бока-Ратон
Google ученый
Арамендиа М.А., Гарсия И., Лафонт Ф. и др. (1995a) Определение изофлавонов с помощью высокоэффективной жидкостной хроматографии с масс-спектрометрией с химической ионизацией при атмосферном давлении. Масс-спектрометр Rapid Comm 9: 503–508
CAS Google ученый
Aramendia MA, Garcia I, Lafont F et al (1995b) Определение изофлавонов с использованием капиллярного электрофореза в сочетании с масс-спектрометрией с электрораспылением.J Chromatogr A 707: 327–333
CAS Google ученый
Arranz A, Saura-Calixto F, Shaha S, Kroon PA (2009) Высокое содержание неизвлекаемых полифенолов во фруктах позволяет предположить, что содержание полифенолов в растительной пище было недооценено. J Agric Food Chem 57: 7298–7303
PubMed CAS Google ученый
Атанасова В., Фулкранд Х, Ле Герневе С. и др. (2002a) Структура нового продукта конденсации димерного ацетальдегида мальвидин-3-глюкозида.Tetrahedron Lett 43: 6151–6153
CAS Google ученый
Атанасова В., Фулкранд Х, Шейнье В., Мутунэ М. (2002b) Влияние оксигенации на изменения полифенолов, происходящие в процессе производства вина. Anal Chim Acta 458: 15–27
CAS Google ученый
Азеведо Дж., Фернандес I, Фариа А. и др. (2010) Антиоксидантные свойства антоцианидинов, антоцианидин-3-глюкозидов и соответствующих портизинов.Food Chem 119: 518–523
CAS Google ученый
Баккалбаси Э., Ментес О, Артик Н. (2009) Пищевые эллагитаннины — появление, последствия обработки и хранения. Crit Rev Food Sci Nutr 49: 283–298
PubMed CAS Google ученый
Баккер Дж., Тимберлейк К.Ф. (1997) Выделение, идентификация и характеристика новых устойчивых к окраске антоцианов, встречающихся в некоторых красных винах.J Agric Food Chem 45: 35–43
CAS Google ученый
Баккер Дж., Бридл П., Хонда Т. и др. (1997) Идентификация антоциана, присутствующего в некоторых красных винах. Фитохимия 44: 1375–1382
CAS Google ученый
Balas L, Vercauteren J (1994) Обширный обратный 2D ЯМР-анализ с высоким разрешением для выяснения структуры олигомеров процианидина.Magn Res Chem 32: 386–393
CAS Google ученый
Baldi A, Romani A, Mulinacci N. et al (1995) Применение ВЭЖХ / МС к антоцианам Vitis vinifera L . J Agric Food Chem 43: 2104–2109
CAS Google ученый
Barofsky D (1988) Применение FAB-MS для выяснения структуры проантоцианидина. В: Hemingway R, Karchesy J (eds) Химия и значение конденсированных танинов.Plenum Press, Нью-Йорк, стр. 175–195
Google ученый
Bate-Smith EC (1948) Бумажная хроматография антоцианов и родственных веществ в экстрактах лепестков. Nature 161: 835–838
PubMed CAS Google ученый
Bate-Smith EC (1953) Цветовые реакции цветов, приписываемые (а) флаванолам и (б) оксидам каротиноидов. J Exp Bot 4: 1–9
Google ученый
Bate-Smith EC (1954) Терпкость в пищевых продуктах.Питание 23: 124–135
CAS Google ученый
Бейт-Смит EC (1962) Фенольные составляющие растений и их таксономическое значение. I. Двудольные. Дж. Линн Соц (бот) 58: 95–173
CAS Google ученый
Bate-Smith EC, Swain T (1962) Флавоноидные соединения. В: Мейсон HS, Флоркин AM (ред.) Сравнительная биохимия, том III. Academic Press, New York, pp 755–809
. Google ученый
Baxter NJ, Lilley TH, Haslam E, Williamson MP (1997) Множественные взаимодействия между полифенолами и слюнными протеиновыми повторами, богатыми пролином, приводят к комплексообразованию и преципитации.Биохимия 36: 5566–5577
PubMed CAS Google ученый
Bazzocco S, Mattila I, Guyot S. et al (2008) Факторы, влияющие на превращение полифенолов яблока в фенольные кислоты и фруктовой матрицы в короткоцепочечные жирные кислоты фекальной микробиотой человека in vitro. Eur J Nutr 47: 442–452
PubMed CAS Google ученый
Benabdeljalil C, Cheynier V, Fulcrand H et al (2000) Mise en évidence de nouveaux пигменты, образованные в результате реакции антоцианов с метаболитами левов.Sci Alim 20: 203–220
CAS Google ученый
Beninger CW, Gu L, Prior RL et al (2007) Изменения полифенолов в семенной оболочке во время процесса последующего потемнения у бобов пегой лошади ( Phaseolus vulgaris L.). J Agric Food Chem 53: 7777–7782
Google ученый
Bennick A (1982) Протеины слюны, богатые пролином. Mol Cell Biochem 45: 83–99
PubMed CAS Google ученый
Boze H, Marlin T, Durand D et al (2010) Богатые пролином белки слюны имеют расширенные конформации.Biophys J 99: 656–665
PubMed CAS Google ученый
Brouillard R, Dangles O (1993) Молекулярные взаимодействия антоцианов — первый шаг в образовании новых пигментов во время выдержки вина. Food Chem 51: 365–371
Google ученый
Brouillard R, Dubois JE (1977) Механизм структурных превращений антоцианов в кислой среде. J Am Chem Soc 99: 1359–1364
CAS Google ученый
Brouillard R, Wigand M, Dangles O, Cheminat A (1991) Влияние pH и растворителя на реакцию совместной пигментации мальвина с полифенолами, производными пурина и пиримидина.J Chem Soc Perkin Trans 2: 1235–1241
Google ученый
Brouillard R, Chassaing S, Isorez G et al (2010) Видимые флавоноиды или антоцианы: от исследований к применению. В: Santos-Buelga C, Escribano-Bailon MT, Lattanzio V (eds) Последние достижения в исследованиях полифенолов, том 2. Blackwell, London, pp. 1-22
Google ученый
Buendia B, Gil MI, Tudela JA et al (2010) Анализ ВЭЖХ-МС олигомеров проантоцианидина и других фенольных соединений в 15 сортах клубники.J Agric Food Chem 58: 3916–3926
PubMed CAS Google ученый
Батлер Л.Г., Прайс М.Л., Brotherton JE (1982) Анализ ванилина на проантоцианидины (конденсированные танины): модификация растворителя для оценки степени полимеризации. J Agric Food Chem 30: 1087–1089
CAS Google ученый
Cadot Y, Caillé S, Samson A et al (2012) Сенсорное представление типичности вин Каберне Франк, связанных с фенольным составом: влияние стадии созревания и времени мацерации.Anal Chim Acta (в стадии пересмотра)
Cai K, Bennick A (2006) Влияние белков слюны на транспорт танина и кверцетина через эпителиальные клетки кишечника в культуре. Biochem Pharmacol 72: 974–980
PubMed CAS Google ученый
Cala O, Pinaud N, Simon C et al (2010) ЯМР и молекулярное моделирование связывания винных танинов с белками слюны: пересмотр терпкости с молекулярных и коллоидных перспектив.FASEB J 24: 4281–4290
PubMed CAS Google ученый
Canon F, Ballivian R, Chirot F et al (2011) Сворачивание изначально неупорядоченного белка слюны при связывании с танинами. J Am Chem Soc 133: 7847–7852
PubMed CAS Google ученый
Charlton AJ, Bacter NJ, Khan ML et al (2002) Связывание полифенолов / пептидов и осаждение. J Agric Food Chem 50: 1593–1601
PubMed CAS Google ученый
Chatonnet P, Dubourdieu D, Boidron JN, Pons M (1992) Происхождение этилфенолов в винах.J Sci Food Agric 60: 165–178
CAS Google ученый
Chatonnet P, Dubourdieu D, Boidron JN, Lavigne V (1993) Синтез летучих фенолов Saccharomyces cerevisiae в вине. J Sci Food Agric 62: 191–202
CAS Google ученый
Cheynier V (2006) Флавоноиды в вине. В: Андерсен О., Маркхэм К. (редакторы) Флавоноиды: химия, биохимия и приложения.CRC Press, Boca Raton, pp. 263–318
Google ученый
Cheynier V, Rigaud J, Souquet JM et al (1989) Влияние контакта выжимок и гиперокисления на фенольный состав и качество вин Гренаш и Шардоне. Am J Enol Vitic 40: 36–42
Google ученый
Cheynier V, Doco T, Fulcrand H et al (1997) ESI-MS анализ полифенольных олигомеров и полимеров.Анализ 25: M32 – M37
CAS Google ученый
Cheynier V, Es-Safi NE, Fulcrand H (1999) Структура и цветовые свойства антоцианов и родственных пигментов. In: Mosquera MIM, Gala MJ, Mendez DH (eds) Протоколы первого международного конгресса по пигментам в продуктах питания и технологиях, Севилья
Cheynier V, Labarbe B, Moutounet M (2001) Оценка длины процианидиновой цепи. Методы Enzymol 335: 82–94
PubMed CAS Google ученый
Cheynier V, Dueñas-Paton M, Salas E et al (2006) Структура и свойства винных пигментов и дубильных веществ.Am J Enol Vitic 57: 298–305
CAS Google ученый
Клиффорд М., Скальберт А. (2000) Эллагитаннины — природа, возникновение и диетическая нагрузка. J Sci Food Agric 80: 1118–1125
CAS Google ученый
Colonna AE, Adams DO, Noble AC (2004) Сравнение процедур уменьшения эффекта переноса терпкости при оценке красных вин. Aust J Grape Wine Res 10: 26–31
Google ученый
Coq S, Souquet JM, Meudec E et al (2010) Межвидовая изменчивость танинов опада листьев способствует разложению в тропических лесах Французской Гвианы.Экология 91: 2080–2091
PubMed Google ученый
Cruz L, Petrov V, Teixeira N et al (2010) Установление химического равновесия различных типов пираноантоцианов в водных растворах: доказательства образования агрегации в пираномальвидин-3-O-кумароилглюкозиде — (+) — катехин. J Phys Chem B 114: 13232–13240
PubMed CAS Google ученый
Czochanska Z, Foo LY, Newman RH et al (1979) Прямое доказательство гомогенной структуры полифлаван-3-ола для полимерных проантоцианидинов.J Chem Soc Chem Comm 375–377
Dangles O (2012) Антиоксидантная активность растительных фенолов: химические механизмы и биологическое значение. Curr Org Chem 16 (6): 692–714
Google ученый
Dangles O, Dufour C (2008) Процессы связывания флавоноидов с белками и их потенциальное влияние на здоровье человека. В: Daayf F, Lattazio V (eds) Последние достижения в исследованиях полифенолов, том 1. Blackwell, London, pp 67–87
Google ученый
de Freitas VAP, Mateus N (2010) Обновление винных пигментов.В: Santos-Buelga C, Escribano-Bailon MT, Lattanzio V (eds) Последние достижения в исследовании полифенолов, том 2. Blackwell, London, pp 59–80
Google ученый
Де Фрейтас В., Матеус Н. (2011) Образование пираноантоцианов в красных винах: новый и разнообразный класс производных антоцианов. Anal Bioanal Chem 401: 1463–1473
PubMed Google ученый
Дауни М.О., Харви Дж. С., Робинсон С. П. (2003) Анализ дубильных веществ в семенах и кожуре винограда Шираз на протяжении развития ягод.Austr J Grape Wine Res 9: 15–27
Google ученый
Drynan JW, Clifford MN, Obuchowicz J, Kuhnert N (2010) Химия низкомолекулярных полифенолов черного чая. Nat Prod Rep 27: 417–462
PubMed CAS Google ученый
Ducasse MA, Canal-Llauberes RM, de Lumley M et al (2010) Влияние обработки мацеративным ферментом на полифенол и полисахаридный состав красных вин.Food Chem 118: 369–376
CAS Google ученый
Duenas M, Salas E, Cheynier V et al (2006) УФ-видимое спектроскопическое исследование пигментов 8-8-метилметин-катехин-мальвидин-3-глюкозид в водном растворе: структурные превращения и молекулярное комплексообразование с хлорогеновой кислотой. J Agric Food Chem 54: 189–196
PubMed CAS Google ученый
Dugelay I, Gunata Z, Sapis JC et al (1993) Роль активности циннамоилэстеразы ферментных препаратов на образование летучих фенолов во время виноделия.J Agric Food Chem 41: 2092–2096
CAS Google ученый
Es-Safi NE, Cheynier V, Moutounet M (2000) Изучение реакций между (+) — катехином и производными фурфурола в присутствии или в отсутствие антоцианов и их влияние на изменение цвета пищи. J Agric Food Chem 48: 5946–5954
Google ученый
Es-Safi NE, Fulcrand H, Cheynier V, Moutounet M (1999a) Исследования индуцированной ацетальдегидом конденсации (-) — эпикатехина и мальвидин-3-O-глюкозида в системе модельного раствора.J Agric Food Chem 47: 2096–2102
PubMed CAS Google ученый
Es-Safi NE, Le Guerneve C, Fulcrand H et al (1999b) Новые полифенольные соединения с ксантильными скелетами, образованными в результате реакции между (+) — катехином и глиоксиловой кислотой. J Agric Food Chem 47: 5211–5217
PubMed CAS Google ученый
Exarchou V, Godejohann M, van Beek TA, Gerothanassis IP, Vervoort J (2003) ЖХ-УФ-твердофазная экстракция-ЯМР-МС в сочетании с зондом криогенного потока и его применение для идентификации соединений, присутствующих в Греческий орегано.Anal Chem 75: 6288–6294
PubMed CAS Google ученый
Foo L, Porter L (1978) Полимеры продельфинидина: определение структурных единиц. J Chem Soc Perkin Trans I: 1186–1190
Google ученый
Foo L, Porter L (1980) Фитохимия проантоцианидиновых полимеров. Фитохим 19: 1747–1754
CAS Google ученый
Foo LY, Lu Y, Howell AB, Vorsa N (2000) Структура проантоцианидинов клюквы, которые ингибируют адгезию уропатогенных P-фимбриированных Escherichia coli in vitro.Фитохимия 54: 173–181
PubMed CAS Google ученый
Fossen P, Andersen OM (2003) Антоцианы из красного лука, Allium cepa , с новым агликоном. Фитохимия 62: 1217–1220
PubMed CAS Google ученый
Fossen T, Andersen OM (2006) Спектроскопические методы, применяемые к флавоноидам. В: Андерсен О., Маркхэм К. (редакторы) Флавоноиды: химия, биохимия и приложения.Тейлор и Фрэнсис, Нью-Йорк, стр. 37–142
Google ученый
Fossen T, Rayyan S, Andersen OM (2004) Димерные антоцианы из клубники ( Fragaria ananassa ), состоящие из пеларгонидин-3-глюкозида, ковалентно связанного с четырьмя флаван-3-олами. Фитохимия 65: 1421–1428
PubMed CAS Google ученый
Francia-Aricha EM, Guerra M, Rivas-Gonzalo J, Santos-Buelga C (1997) Новые антоциановые пигменты, образованные после конденсации с флаванолами.J Agric Food Chem 45: 2262–2266
CAS Google ученый
Fulcrand H, Doco T, Es Safi N, Cheynier V (1996a) Исследование полимеризации флаван-3-олов, вызванной ацетальдегидом, с помощью жидкостной хроматографии — масс-спектрометрии с ионным распылением. J Chromatogr 752: 85–91
CAS Google ученый
Fulcrand H, Cameira dos Santos P, Sarni-Manchado P et al (1996b) Структура новых винных пигментов на основе антоцианов.J Chem Soc Perkin Trans 1 (7): 735–739
Google ученый
Fulcrand H, Cheynier V, Oszmianski J, Moutounet M (1997a) Остаток окисленной винной кислоты как новый мостик, потенциально конкурирующий с ацетальдегидом при конденсации флаван-3-ола. Фитохимия 46: 223–227
CAS Google ученый
Fulcrand H, Hapiot P, Neta P et al (1997b) Электрохимическое и радиолитическое окисление природных фенолов.Анализ 25: M38 – M43
CAS Google ученый
Fulcrand H, Remy S, Souquet JM et al (1999a) Идентификация таниновых олигомеров вина с помощью онлайн-жидкостной хроматографии, электрораспылительной ионизационной масс-спектрометрии. J Agric Food Chem 47: 1023–1028
PubMed CAS Google ученый
Fulcrand H, Guyot S, Le Roux E et al (1999b) Вклад электрораспыления в структурный анализ олигомеров и полимеров конденсированных таннинов.В: Hemingway R (ed) Растительные полифенолы 2: биогенез, химические свойства и значение. Plenum Press, Нью-Йорк, стр. 223–244
Google ученый
Fulcrand H, Dueñas M, Salas E, Cheynier V (2006) Фенольные реакции во время виноделия и выдержки. Am J Enol Vitic 57: 289–297
CAS Google ученый
Фулкранд Х., Мане С., Прейс С. и др. (2008) Подходы прямой масс-спектрометрии для характеристики полифенольного состава сложных образцов.Фитохимия 69: 3131–3138
PubMed CAS Google ученый
Гарсия-Алонсо М., Римбах Дж., Саса М. и др. (2005) Исследования с помощью спектроскопии электронного спинового резонанса активности антоцианов и пираноантоцианов вина по улавливанию свободных радикалов. Mol Nutr Food Res 49: 1112–1119
PubMed CAS Google ученый
Гил М.И., Томас-Барберан Ф.А., Хесс-Пирс Б., Холкрофт Д.М., Кафер А.А. (2000) Антиоксидантная активность гранатового сока и ее связь с фенольным составом и обработкой.J Agric Food Chem 48: 4581–4589
PubMed CAS Google ученый
Gil AM, Duarte IF, Godejohann M, Braumann U, Maraschin M, Spraul M (2003) Характеристика ароматического состава некоторых жидких пищевых продуктов с помощью спектрометрии ядерного магнитного резонанса и жидкостной хроматографии с ядерным магнитным резонансом и масс-спектрометрическим детектированием. Анальный патрубок Acta 488: 35–51
CAS Google ученый
Goldstein JL, Swain T (1963) Изменения дубильных веществ в созревающих фруктах.Фитохимия 2: 371–383
CAS Google ученый
Gonçalves R, Mateus N, Pianet I et al (2011) Механизмы ингибирования трипсина, индуцированного танином: молекулярный подход. Ленгмюр 27: 13122–13129
PubMed Google ученый
González-Manzano S, Mateus N, de Freitas V, Santos-Buelga C (2008) Влияние степени полимеризации на способность катехинов действовать как копигменты антоцианов.Eur Food Res Technol 227: 83–92
Google ученый
González-Manzano S, Dueñas M, Rivas-Gonzalo JC et al (2009) Исследования совместной пигментации антоцианов и флаван-3-олов и их влияния на выражение цвета красного вина. Food Chem 114: 649–656
Google ученый
Gonzalez-Paramas AM, Lopes da Silva F, Martin-Lopez P et al (2006) Пигменты, конденсированные с флаванолом и антоцианом, в растительных экстрактах.Food Chem 94: 428–436
CAS Google ученый
Gould KS (2010) Мюриэль Велдейл Онслоу и повторное открытие функции антоцианов в растениях. В: Santos-Buelga C, Escribano-Bailon MT, Lattanzio V (eds) Последние достижения в исследовании полифенолов, том 2. Blackwell, London, стр. 206–225
Google ученый
Goupy P, Dufour C, Loonis M, Dangles O (2003) Количественный кинетический анализ реакций переноса водорода от пищевых полифенолов к радикалу DPPH.J Agric Food Chem 5: 615–622
Google ученый
Goupy P, Bautista-Ortin AB, Fulcrand H, Dangles O (2009) Антиоксидантная активность винных пигментов, полученных из антоцианов: реакции переноса водорода на радикал DPPH и ингибирование индуцированного гемом перекисного окисления линолевой кислоты. J Agric Food Chem 57: 5762–5770
PubMed CAS Google ученый
Gu L, Kelm M, Hammerstone JF et al (2002) Фракционирование полимерных процианидинов из низкорослой черники и количественное определение процианидинов в отобранных пищевых продуктах с помощью оптимизированного метода флуоресцентного обнаружения ВЭЖХ-МС с нормальной фазой.J Agric Food Chem 50: 4852–4860
PubMed CAS Google ученый
Gu L, Kelm MA, Hammerstone JF et al (2003) Скрининг пищевых продуктов, содержащих проантоцианидины, и их структурная характеристика с использованием ЖХ-МС / МС и тиолитического разложения. J Agric Food Chem 51: 7513–7521
PubMed CAS Google ученый
Gu L, Kelm M, Hammerstone JF et al (2004) Концентрации проантоцианидинов в обычных пищевых продуктах и оценки нормального потребления.J Nutr 134: 613–617
PubMed CAS Google ученый
Guinard J-X, Pangborn RM, Lewis MJ (1986) Динамика терпкости вина при многократном употреблении. Am J Enol Vitic 37: 184–189
Google ученый
Guyot S, Vercauteren J, Cheynier V (1996) Бесцветные и желтые димеры, полученные в результате окислительного сочетания (+) — катехина, катализируемого полифенолоксидазой винограда.Phytochem 42: 1279–1288
CAS Google ученый
Guyot S, Doco T, Souquet JM et al (1997) Характеристика высокополимеризованных процианидинов в кожуре и мякоти яблочного сидра ( Malus sylvestris var. Kermerrien). Phytochem 44: 351–357
CAS Google ученый
Guyot S, Guernevé CL, Marnet N, Drilleau JF (1999) In: Gross GG, Hemingway RW, Yoshida T, Branham S (eds) Полифенолы растений 2, химия, биология, фармакология, экология.Kluwer / Academic Plenum Publishers, Нью-Йорк, стр. 211–222
Google ученый
Hagerman AE (2012) 50 лет полифенол-белковых комплексов. В: Cheynier V, Sarni-Manchado P, Quideau S (eds) Последние достижения в исследованиях полифенолов, том 3. Blackwell, London (в печати)
Hagerman AE, Butler LG (1981) Специфичность взаимодействий проантоцианидин-белок . J Biol Chem 256: 4494–4497
PubMed CAS Google ученый
Hagerman AE, Robbins CT (1987) Значение растворимых танин-белковых комплексов для анализа танинов и механизмов защиты растений.J Chem Ecol 13: 1243–1254
CAS Google ученый
Hagerman AE, Robbins CT (1993) Специфичность связывающих танин белков слюны по сравнению с выбором диеты млекопитающими. Can J Zool 71: 628–633
CAS Google ученый
Hagerman AE, Rice ME, Ritchard NT (1998) Механизмы преципитации белка для двух танинов, пентагаллоилглюкозы и эпикатехин (4 → 8) катехин (процианидин).J Agric Food Chem 46: 2590–2595
CAS Google ученый
Halliwell B, Rafter J, Jenner A (2005) Укрепление здоровья с помощью флавоноидов, токоферолов, токотриенолов и других фенолов: прямые или косвенные эффекты? Антиоксидант или нет? Am J Clin Nutr 81: 268S – 276S
PubMed CAS Google ученый
Harbowy ME, Balentine DA (1997) Чайная химия. Crit Rev Plant Sci 16: 415–480
CAS Google ученый
Haslam E (1980) In vino veritas: олигомерные процианидины и выдержка красных вин.Фитохимия 19: 2577–2582
CAS Google ученый
Haslam E (1998) Практические полифенолы: от структуры до молекулярного распознавания и физиологического действия. Издательство Кембриджского университета, Кембридж
Google ученый
Haslam E (2003) Мысли о теарубигинах. Фитохимия 64: 61–73
PubMed CAS Google ученый
Haslam E (2007) Растительные дубильные вещества — уроки фитохимической жизни.Фитохимия 68: 2713–2721
PubMed CAS Google ученый
Haslam E, Cai Y (1994) Растительные полифенолы (растительные дубильные вещества) — метаболизм галловой кислоты. Nat Prod Rep 11: 41–66
PubMed CAS Google ученый
He J, Carnalho ARF, Mateus N, de Freitas V (2010) Спектральные особенности и стабильность олигомерных пираноантоцианин-флаванольных пигментов, выделенных из красных вин.J Agric Food Chem 58: 9249–9258
CAS Google ученый
Hellstrom J, Torronen AR, Mattila PH (2009) Проантоцианидины в обычных пищевых продуктах растительного происхождения. J Agric Food Chem 57: 7899–7906
PubMed CAS Google ученый
Hollman PC, Cassidy A, Comte B, et al (2011) Биологическая значимость прямого антиоксидантного действия полифенолов для здоровья сердечно-сосудистой системы у людей не установлена.J Nutr 141: 989S – 1009S
Google ученый
Джослин М.А., Гольдштейн Дж.Л. (1964) Терпкость фруктов и фруктовых продуктов по отношению к содержанию фенолов. Adv Food Res 13: 179–217
PubMed CAS Google ученый
Jurd L (1969) Обзор реакций конденсации полифенолов и их возможное возникновение при старении вин. Am J Enol Vitic 20: 191–195
CAS Google ученый
Karchesy JJ, Hemingway RW (1980) Полифлаваноиды коры сосны лоблоли.J Agric Food Chem 28: 222–228
CAS Google ученый
Kelm MA, Johnson JC, Robbins RJ et al (2006) Разделение с помощью высокоэффективной жидкостной хроматографии и очистка процианидинов какао ( Theobroma cacao L.) в зависимости от степени полимеризации с использованием диольной стационарной фазы. J Agric Food Chem 54: 1571–1576
PubMed CAS Google ученый
Kennedy JA, Taylor AW (2003) Анализ проантоцианидинов с помощью высокоэффективной гель-проникающей хроматографии.J Chromatogr A 995: 99–107
PubMed CAS Google ученый
Kennedy JA, Mattews MA, Waterhouse AL (2000) Изменения полифенолов виноградных косточек во время созревания плодов. Фитохимия 55: 77–85
PubMed CAS Google ученый
Kennedy JA, Hayasaka Y, Vidal S. et al (2001) Состав проантоцианидинов кожуры винограда на разных стадиях развития ягод.J Agric Food Chem 49: 5348–5355
PubMed CAS Google ученый
Koponen JM, Happonen AM, Mattila PH, Törrönen AR (2007) Содержание антоцианов и эллагитаннинов в избранных пищевых продуктах, потребляемых в Финляндии. J Agric Food Chem 55: 1612–1619
PubMed CAS Google ученый
Koupai-Abyazani MR, McCallum J, Bohm BA (1992) Идентификация составляющих флаваноидных единиц в проантоцианидинах эспарцета с помощью высокоэффективной жидкостной хроматографии с обращенной фазой.J Chromatogr 594: 117–123
CAS Google ученый
Koupai-Abyazani MR, McCallum J, Muir AD et al (1993) Очистка и характеристика проантоцианидинового полимера из семян люцерны ( Medicago sativa Cv. Beaver). J Agric Food Chem 41: 565–569
CAS Google ученый
Krueger CG, Dopke NC, Treichel PM, Folts J, Reed JD (2000) Матричная лазерная десорбционная / ионизационная времяпролетная масс-спектрометрия полигаллоилполифлаван-3-олов в экстракте виноградных косточек.J Agric Food Chem 48: 1663–1667
Google ученый
Kuhnert N (2010) Раскрытие структуры теарубигинов черного чая. Arch Biochem Biophys 501: 37–51
PubMed CAS Google ученый
Kuhnert N, Drynan JW, Obuchowicz J et al (2010) Масс-спектрометрическая характеристика теарубигинов черного чая, приводящая к гипотезе окислительного каскада для образования теарубигина.Rapid Commun Mass Spectrom 24: 3387–3404
PubMed CAS Google ученый
Lambert SG, Asentorfer RE, Williamson NM et al (2011) Копигментация между мальвидин-3-глюкозидом и некоторыми составляющими вина и ее важность для выражения цвета в красном вине. Food Chem 125: 106–115
CAS Google ученый
Le Bourvellec C, Renard CMGC (2005) Нековалентное взаимодействие между процианидинами и материалом клеточной стенки яблока.Часть II: количественная оценка и влияние высыхания клеточной стенки. Biochim Biophys Acta Общие предметы 1725: 1–9
Google ученый
Le Roux E, Doco T, Sarni-Manchado P et al (1998) Характеристика проантоцианидинов A-типа из околоплодника личи ( Litchi sinensis Sonn.). Фитохимия 48: 1251–1258
Google ученый
Lea AGH (1978) Фенольные соединения сидра: олигомерные и полимерные процианидины.J Sci Food Agric 29: 471–477
PubMed CAS Google ученый
Lee JE, Hwang GS, van Den Berg F, Lee CH, Hong YS (2009) Anal Chim Acta 648: 71–76
Google ученый
Li XC, Ferreira D, Ding Y (2010) Определение абсолютной конфигурации натуральных продуктов: теоретический расчет электронного кругового дихроизма как инструмент. Curr Org Chem 14: 1678–1697
CAS Google ученый
Liao H, Cai Y, Haslam E (1992) Взаимодействия полифенолов.6. Антоцианы-копигментация и изменение цвета красных вин. J Sci Food Agric 59: 299–305
CAS Google ученый
Luck G, Liao H, Murray NJ et al (1994) Полифенолы, терпкость и богатые пролином белки. Фитохимия 37: 357–371
PubMed CAS Google ученый
Mabry TJ, Markham KR, Thomas MB (1970) Систематическая идентификация флавоноидов.Спрингер, Нью-Йорк
Google ученый
Manach C, Hubert J, Llorach R, Scalbert A (2009) Обзор: сложные связи между диетическими фитохимическими веществами и здоровьем человека, расшифрованные с помощью метаболомики. Mol Nutr Food Res 53: 1303–1315
Google ученый
Mané C, Souquet JM, Olle D et al (2007a) Оптимизация одновременной экстракции флаванола, фенольной кислоты и антоциана из винограда с использованием экспериментального плана: приложение для характеристики сортов винограда Шампань.J Agric Food Chem 55: 7224–7233
PubMed Google ученый
Mané C, Sommerer N, Yalcin T et al (2007b) Оценка молекулярно-массового распределения таниновых фракций с помощью MALDI-TOF MS-анализа комплексов белок-танин. Anal Chem 79: 2239–2248
PubMed Google ученый
Mareca Cortès I, de Campos Salcedo M (1957) Sur la combinaison de I’ethanal et des polyphénols dans les vins rouges.Ind Agr Aliment 74: 103–106
Google ученый
Markham KR, Geiger H (1994) 1 H Спектроскопия ядерного магнитного резонанса флавоноидов и их гликозидов в гексадейтеродиметилсульфоксиде. В: Harborne JB (ed) Флавоноиды, достижения в исследованиях с 1986 года. Chapman & Hall / CRC, Boca Raton
Google ученый
Martin AJP, Synge RLM (1941) Новая форма хроматограммы с использованием двух жидких фаз.Biochem J 35: 1358–1368
PubMed CAS Google ученый
Мартин Р., Лилли Т.Х., Бейли Н.А. и др. (1986). Комплексообразование полифенол-кофеин. J Chem Soc Chem Commun 105–106
Mateus N, Silva AM, Rivas-Gonzalo JC et al (2003) Новый класс синих пигментов на основе антоцианов, выделенных из красных вин. J Agric Food Chem 51: 1919–1923
PubMed CAS Google ученый
Mateus N, Oliveira J, Pissarra J et al (2006) Новый пигмент винилпираноантоцианин, встречающийся в выдержанном красном вине.Food Chem 97: 689–695
CAS Google ученый
Mattivi F, Guzzon R, Vrhovsek U et al (2006) Профилирование метаболитов винограда: флавонолы и антоцианы. J Agric Food Chem 54: 7692–7702
PubMed CAS Google ученый
Maury C, Sarni-Manchado P, Lefèbvre S et al (2001) Влияние оклейки желатинами с разной молекулярной массой на состав проантоцианидинов и восприятие вин.Am J Enol Vitic 52: 140–145
CAS Google ученый
Mazerolles G, Preys S, Bouchut C et al (2010) Сочетание нескольких режимов ионизации масс-спектрометрии: многоблочный анализ для быстрой характеристики полифенольного состава красного вина. Anal Chim Acta 678: 195–202
PubMed CAS Google ученый
McManus JP, Davis KG, Beart JE et al (1985) Взаимодействия полифенолов.Часть 1. Введение: некоторые наблюдения об обратимом комплексообразовании полифенолов с белками и полисахаридами. J Chem Soc Perkin Trans II: 1429–1438
Google ученый
McMurrough I, McDowell I (1978) Хроматографическое разделение и автоматический анализ флаванолов. Анальная биохимия 91: 92–100
PubMed CAS Google ученый
Mehansho H, Butler LG, Carlson DM (1987) Пищевые танины и богатые пролином белки слюны: взаимодействия, индукция и механизмы защиты.Энн Рев Нутр 7: 423–440
CAS Google ученый
Morel-Salmi C, Souquet JM, Bes M, Cheynier V (2006) Влияние обработки мгновенным высвобождением на фенольную экстракцию и состав вина. J Agric Food Chem 54: 4270–4276
PubMed CAS Google ученый
Mouls L, Mazauric JP, Sommerer N. et al (2011) Комплексное исследование конденсированных таннинов с помощью масс-спектрометрии ESI: определение средней степени полимеризации и распределения полимера по масс-спектрам.Анал Биоанал Хим. 400: 613–623
PubMed CAS Google ученый
Murray NJ, Williamson MP (1994) Конформационное исследование повторяющейся последовательности белка с высоким содержанием пролина в слюне. Eur J Biochem 219: 915–921
PubMed CAS Google ученый
Murray NJ, Williamson MP, Lilley TH, Haslam E (1994) Изучение взаимодействия между богатыми пролином белками и полифенолом с помощью спектроскопии ЯМР 1H.Eur J Biochem 219: 923–935
PubMed CAS Google ученый
Nave F, Teixeira N, Mateus N, de Freitas V (2010) Судьба аддуктов флаванола и антоциана в винах: изучение их предполагаемых паттернов реакции в присутствии ацетальдегида. Food Chem 121: 1129–1138
CAS Google ученый
Nayak A, Carpenter GH (2008) Физиологическая модель терпкости, вызванной чаем.Physiol Behav 95: 290–294
PubMed CAS Google ученый
Neveu V, Perez-Jiménez J, Vos F et al (2010) Phenol-Explorer: комплексная онлайн-база данных о содержании полифенолов в пищевых продуктах. База данных. DOI: 10.1093 / база данных / bap024
Nilsson M, Duarte I, Delgadillo I. et al (2004) ЯМР высокого разрешения и диффузионно-упорядоченная спектроскопия портвейна. J Agric Food Chem 52: 3736–3743
PubMed CAS Google ученый
Нисиока И., Нонака Г., Танака Т., Сакаи Т., Михаши К. (1990) Танины и родственные соединения.97. Структурная ревизия С-гликозидных эллагитаннинов, касталагина, вескалагина, казуаринина и стахюрина и родственных гидролизуемых эллагитаннинов. Chem Pharm Bull 38: 2151–2156
Google ученый
Nonier MF, Absalon C, Vivas N. et al (2004) Применение автономного хроматографического фракционирования с вытеснением по размеру — матричная лазерная десорбция, ионизация, время пролета, масс-спектрометрия для характеристики проантоцианидина. J Chromatogr A 1033: 291–297
PubMed CAS Google ученый
Ohnishi-Kameyama M, Yanagida A, Kanda T, Nagata T (1997) Идентификация олигомеров катехина из яблока ( Malus pumila cv.Fuji) в времяпролетной масс-спектрометрии с матричной десорбцией / ионизацией и масс-спектрометрии с бомбардировкой быстрыми атомами. Масс-спектрометр Rapid Comm 11: 31–36
CAS Google ученый
Окуда Т. (1999) Новые аспекты дубильных веществ — обновленные концепции и взаимосвязи структура-активность. Curr Org Chem 3: 609–622
CAS Google ученый
Окуда Т., Йошида Т., Хатано Т., Кога Т., Тох Н., Курияма К. (1982a) Круговой дихроизм гидролизуемых танинов.I. Эллагитаннины и галлотанины. Tetrahedron Lett 23: 3937–3940
CAS Google ученый
Окуда Т., Йошида Т., Хатано Т., Кога Т., Тох Н., Курияма К. (1982b) Круговой дихроизм гидролизуемых танинов. II. Дегидроэллагитаннины. Tetrahedron Lett 23: 3941–3944
CAS Google ученый
Окуда Т., Хатано Т., Йошида Т. (1990) Олигомерные гидролизуемые танины, новый класс растительных полифенолов.Гетероциклы 30: 1195–1218
CAS Google ученый
Окуда Т., Хатано Т., Йошида Т. (1993) Полифенолы новых типов и их корреляция с систематикой растений. Фитохимия 32: 507–522
CAS Google ученый
Окуда Т., Йошида Т., Хатано Т. (1995) Гидролизуемые танины и родственные полифенолы. В: Herz W, Kirby GW, Moore RE, Steglich W, Tamm Ch (eds) Progress in the chemistry of organic natural products, vol 66.Springer, Vienna, pp. 1–117
Google ученый
Okuda T, Yoshida T, Hatano T, Ito H (2009) Эллагитаннины обновили концепцию танинов. В: Quideau S (ed) Химия и биология эллагитаннинов — недооцененного класса биоактивных полифенолов растений. World Scientific, Сингапур, стр. 1–54
Google ученый
Oliveira C, Mateus N, Silva A, de Freitas V (2009) Равновесные формы пигментов Vitisin B в водной системе, изученные методами ЯМР и видимой спектроскопии.J Phys Chem 113: 11352–11358
CAS Google ученый
Oliveira J, Azevedo J, Silva AMS et al (2010) Пираноантоцианиновые димеры: новое семейство бирюзово-синих пигментов, полученных из антоцианов, обнаруженных в портвейне. J Agric Food Chem 58: 5154–5159
PubMed CAS Google ученый
Ollis WD, Brown AG, Haslam E et al (1966) Состав теафлавина.Tetrahedron Lett 1193–1204
Oszmianski J, Wojdylo A (2009) Сравнительное исследование фенольного содержания и антиоксидантной активности клубничного пюре, прозрачных и мутных соков. Eur Food Res Technol 228: 623–631
CAS Google ученый
Pascal C, Poncet-Legrand C, Imberty A et al (2007) Взаимодействие между негликозилированным белком, богатым пролином человека, и флаван-3-олами. J Agric Food Chem 55: 4895–4901
PubMed CAS Google ученый
Pascal C, Pate F, Cheynier V, Delsuc MA (2009) Изучение взаимодействий между богатым пролином белком и флаван-3-олом с помощью ЯМР: остаточные структуры в нативно развернутом белке обеспечивают точки закрепления лигандов .Биополимеры 91: 745–756
PubMed CAS Google ученый
Pérez-Jiménez J, Arranz S, Saura-Calixto F (2009) Содержание проантоцианидина в пищевых продуктах в значительной степени занижено в литературных данных: подход к количественной оценке недостающих проантоцианидинов. Food Res Internat 42: 1381–1388
Google ученый
Пиркер К.Ф., Оливейра Дж., Де Фрейтас В.и др. (2011) Антирадикальные свойства портизинов из красного вина.J Agric Food Chem 59: 11833–11837
PubMed CAS Google ученый
Poncet-Legrand C, Cartalade D, Putaux JL et al (2003) Агрегация флаван-3-ола в модельных этанольных растворах: степень полифенольной структуры, концентрации, содержания этанола и ионной силы. Ленгмюр 19: 10563–10572
CAS Google ученый
Poncet-Legrand C, Doco T, Williams P, Vernhet A (2007) Ингибирование агрегации танинов виноградных косточек винными маннопротеинами: влияние молекулярной массы полисахарида.Am J Enol Vitic 58: 87–91
Google ученый
Poncet-Legrand C, Cabane B, Bautista-Ortin AB et al (2010) Окисление танина: внутри- и межмолекулярные реакции. Биомакромолекулы 11: 2376–2386
PubMed CAS Google ученый
Porter LJ, Hrstich LN, Chan BG (1986) Превращение процианидинов и продельфинидинов в цианидин и дельфинидин. Фитохимия 25: 223–230
CAS Google ученый
Pourcel L, Routaboul JM, Cheynier V et al (2007) Окисление флавоноидов в растениях: от биохимических свойств до физиологических функций.Trends Plant Sci 12: 29–36
PubMed CAS Google ученый
Prieur C, Rigaud J, Cheynier V, Moutounet M (1994) Олигомерные и полимерные процианидины из косточек винограда ( Vitis vinifera ). Фитохимия 36: 781–784
CAS Google ученый
Quideau S (2009) Химия и биология эллагитаннинов — недооцененного класса биоактивных полифенолов растений.World Scientific, Сингапур
Google ученый
Quideau S, Deffieux D, Douat-Casassus C, Pouységu L (2011) Полифенолы растений: химические свойства, биологическая активность и синтез. Angew Chem Int Ed 50: 586–621
CAS Google ученый
Remy S, Fulcrand H, Labarbe B et al (2000) Первое подтверждение в красном вине продуктов, полученных в результате прямых антоцианин-таниновых реакций.J Sci Food Agric 80: 745–751
CAS Google ученый
Revilla I, Perez-Magarino S, Gonzalez-SanJose ML, Beltran S (1999) Идентификация производных антоцианов в экстрактах виноградной кожицы и красных винах методом жидкостной хроматографии с диодной матрицей и масс-спектрометрическим детектированием. J Chromatogr A 847: 83–90
CAS Google ученый
Rigaud J, Escribano-Bailon MT, Prieur C et al (1993) Нормально-фазовое высокоэффективное жидкостное хроматографическое разделение процианидинов из бобов какао и виноградных косточек.J Chromatogr 654: 255–260
CAS Google ученый
Riou V, Vernhet A, Doco T, Moutounet M (2002) Агрегация танинов виноградных косточек в модели — эффект полисахаридов вина. Food Hydrocoll 16: 17–23
CAS Google ученый
Робертс EAH, Картрайт Р.А., Oldschool M (1959) Фенольные вещества промышленного чая. I. Фракционирование и бумажная хроматография водорастворимых веществ.J Sci Food Agric 8: 72–80
Google ученый
Робертс EAH (1962) Экономическое значение флавоноидных веществ: ферментация чая. В: Гейссман Т.А. (ред.) Химия флавоноидных соединений. Pergamon Press, Oxford, pp. 468–512
Rosenheim O (1920) XXI. Наблюдения за антоцианами. Антоцианы молодых листьев виноградной лозы. Biochem J 14: 178–188
PubMed CAS Google ученый
Sacchi LK, Bisson LF, Adams DO (2005) Обзор влияния методов виноделия на фенольную экстракцию в красных винах.Am J Enol Vitic 56: 197–206
CAS Google ученый
Salas E, Atanasova V, Poncet-Legrand C et al (2004a) Демонстрация присутствия аддуктов флаванол-антоциан в вине и в модельных растворах. Анальный патрубок Acta 513: 325–332
CAS Google ученый
Salas E, Le Guernevé C, Fulcrand H et al (2004b) Определение структуры и цветовых свойств нового напрямую связанного димера флаванола-антоциана.Tetrahedron Lett 45: 8725–8729
CAS Google ученый
Салас Э., Дуэньяс М., Шварц М. и др. (2005) Характеристика пигментов из различных фракций вина, полученных с помощью высокоскоростной противоточной хроматографии. J Agric Food Chem 53: 4536–4546
PubMed CAS Google ученый
Sarni-Manchado P et al (1996) Стабильность и цвет незарегистрированных винных пигментов, полученных из антоцианов.J Food Sci 61: 938–941
CAS Google ученый
Saucier C, Little D, Glories Y (1997a) Первое свидетельство продуктов конденсации ацетальдегид-флаванол в красном вине. Am J Enol Vitic 48: 370–373
CAS Google ученый
Saucier C, Bourgeois G, Vitry C et al (1997b) Характеристика (+) — катехин-ацетальдегидных полимеров: модель коллоидного состояния винных полифенолов.J Agric Food Chem 45: 1045–1049
CAS Google ученый
Self R, Eagles J, Galetti GC, Mueller-Harvey I (1986) Масс-спектрометрия полифенолов (син. Растительные танины) с бомбардировкой быстрыми атомами. Масс-спектр биомедицинской среды 13: 449–468
CAS Google ученый
Shen Z, Haslam E, Falshaw CP, Begley MJ (1986) Процианидины и полифенолы коры Larix gmelini .Фитохимия 25: 2629–2635
CAS Google ученый
Simon C, Barathieu K, Laguerre M et al (2003) Трехмерная структура и динамика белковых комплексов винного танина и слюны. Мультитехнический подход. Биохимия 42: 10385–10395
PubMed CAS Google ученый
Singleton VL (1995) Созревание вин и спиртных напитков: сравнения, факты и гипотезы.Am J Enol Vitic 46: 98–115
CAS Google ученый
Singleton VL, Berg HW, Guymont JF (1964) Уровень цвета антоциана в винах портвейна, на который влияет использование винных спиртов, содержащих альдегиды. Am J Enol Vitic 15: 75–81
CAS Google ученый
Slade D, Ferreira D, Marais JPJ (2005) Круговой дихроизм, мощный инструмент для оценки абсолютной конфигурации флавоноидов.Фитохимия 66: 2177–2215
PubMed CAS Google ученый
Somers TC (1966) Винные танины — выделение конденсированных флавоноидных пигментов гель-фильтрацией. Nature 209 (368–3): 70
Google ученый
Somers TC (1971) Полимерная природа винных пигментов. Фитохимия 10: 2175–2186
CAS Google ученый
Souquet JM, Cheynier V, Brossaud F, Moutounet M (1996) Полимерные проантоцианидины из кожуры винограда.Фитохимия 43: 509–512
CAS Google ученый
Souquet JM, Drinkine J, Morel-Salmi C et al (2008) Фенольные соединения Syrah. Proc Int Syrah Symp Lyon 75–81
Sousa C, Mateus N, Silva AMS et al (2007) Структурная и хроматическая характеристика нового пигмента мальвидин-3-глюкозид-ваниллил-катехин. Food Chem 102: 1344–1351
CAS Google ученый
Stringano E, Gea A, Salminen JP, Mueller-Harvey I (2011) Простое решение сложной проблемы: проантоцианидины, галлоилглюкозы и эллагитаннины соответствуют одной калибровочной кривой в высокоэффективной гель-проникающей хроматографии.J Chromatogr A 1218: 7804–7812
PubMed CAS Google ученый
Taira S, Ono M (1997) Снижение терпкости хурмы, вызванное адгезией танинов к фрагментам клеточной стенки. Acta Horticulturae 436: 235–241
CAS Google ученый
Тайра С., Оно М., Мацумото Н. (1998) Снижение терпкости хурмы за счет образования комплекса между пектином и танинами.Послеуборочная Биол Технол 12: 265–271
Google ученый
Takahata Y, Ohnishi-Kameyama M, Furuta S. et al (2001) Высокополимеризованные процианидины в коричневой оболочке семян сои с высокой активностью улавливания радикалов. J Agric Food Chem 49: 5843–5847
PubMed CAS Google ученый
Takino Y, Ferretti A, Flanagan V et al (1965) Структура теафлавина, полифенола черного чая.Tetrahedron Lett 4019–4025
Тамура Ф., Танабе К., Итаи А., Хасегава М. (1999) Характеристики накопления ацетальдегида и устранения терпкости с помощью обработки этанолом и двуокисью углерода в плодах хурмы «Сайджо». J Jap Soc Hort Sci 68: 1178–1183
CAS Google ученый
Танака Т., Такахаши Р., Куно И., Нонака К. (1994) Химические доказательства снижения терпкости (перевод в нерастворимую форму танинов) плодов хурмы.J Chem Soc Perkin Trans 1: 3013–3022
Google ученый
Танака Т., Мацуо Ю., Куно И. (2010) Химия вторичных полифенолов, образующихся при обработке чая и избранных продуктов. Int J Mol Sci 11: 14–40
CAS Google ученый
Tarascou I, Mazauric JP, Meudec E et al (2011) Характеристика подлинных и производных проантоцианидинов клюквы с помощью LC-ESI-MS.Food Chem 128: 802–810
CAS Google ученый
Taylor AW, Barofsky E, Kennedy JA et al (2003) Проантоцианидины хмеля ( Humulus lupulus L.), охарактеризованные с помощью масс-спектрометрии, кислотного катализа и гель-проникающей хроматографии. J Agric Food Chem 51: 4101–4110
PubMed CAS Google ученый
Thompson RS, Jacques D, Haslam E, Tanner DJN (1972) Выращивайте проантоцианидины.Часть. I. Введение: выделение, структура и распределение в природе процианидинов растений. J Chem Soc Perkin Trans I: 1387–1399
Google ученый
Timberlake CF, Bridle P (1976) Взаимодействие между антоцианами, фенольными соединениями и ацетальдегидом и их значение в красных винах. Am J Enol Vitic 27: 97–105
CAS Google ученый
Torronen R (2009) Источники и влияние диетических эллагитаннинов на здоровье.В: Quideau S (ed) Химия и биология эллагитаннинов — недооцененного класса биоактивных полифенолов растений. World Scientific, Сингапур, стр. 298–319
Google ученый
Treutter D, Santos-Buelga C, Gutmann M, Kolodziej H (1994) Идентификация флаван-3-ола и процианидинов с помощью высокоэффективной жидкостной хроматографии и обнаружения химической реакции. J Chromatogr A 667: 290–297
CAS Google ученый
Uclés Santos JR, Bakry F, Brillouet JM (2010) Предварительное хемотаксономическое исследование конденсированных танинов мякоти зеленого банана в роде Musa .Biochem Syst Ecol 38: 1010–1017
Google ученый
Министерство сельского хозяйства США, Служба сельскохозяйственных исследований (2004) База данных USDA по содержанию проантоцианидина в отдельных пищевых продуктах. http://www.nal.usda.gov/fnic/foodcomp/Data/PA/PA.pdf
Министерство сельского хозяйства США, Служба сельскохозяйственных исследований (2011) База данных USDA по содержанию флавоноидов в отобранных пищевых продуктах, версия 3.0. http: // www.ars.usda.gov/nutrientdata/flav
Vernhet A, Dubascoux S, Cabane B et al (2011) Характеристика окисленных таннинов: сравнение методов деполимеризации, асимметричного полевого фракционирования потока и малоуглового рассеяния рентгеновских лучей. Anal Bioanal Chem 401: 1559–1569
PubMed Google ученый
Verries C, Guiraud JL, Souquet JM et al (2008) Валидация метода экстракции для всего околоплодника виноградной ягоды ( Vitis vinifera L.резюме. Шираз) для изучения биохимических и молекулярных аспектов синтеза флаван-3-ола в процессе развития ягод. J Agric Food Chem 56: 5896–8904
PubMed CAS Google ученый
Vidal S, Cattalade D, Souquet JM et al (2002) Изменения длины цепи проантоцианидина в винных модельных растворах. J Agric Food Chem 50: 2261–2266
PubMed CAS Google ученый
Видал С., Фрэнсис Л., Гайот С. и др. (2003a) Вкус проантоцианидинов винограда и яблока в виноподобной среде.J Sci Food Agric 83: 564–573
CAS Google ученый
Vidal S, Courcoux P, Francis L et al (2003b) Использование экспериментального подхода к дизайну для оценки ключевых компонентов вина на вкусовом восприятии. Food Qual Pref 15: 209–217
Google ученый
Vidal S, Meudec E, Cheynier V et al (2004a) Масс-спектрометрические данные о существовании олигомерных антоцианов в кожуре винограда.J Agric Food Chem 52: 7144–7151
PubMed CAS Google ученый
Видал С., Фрэнсис Л., Квятковски М. и др. (2004b) Вкусовые и вкусовые свойства различных типов таниноподобных полифенольных соединений и антоцианов в вине. Анальный патрубок Acta 513: 57–65
CAS Google ученый
Weber HA, Hodges AE, Guthrie JR et al (2007) Сравнение проантоцианидинов в коммерческих антиоксидантах: экстрактах виноградных косточек и сосновой коры.J Agric Food Chem 55: 148–156
PubMed CAS Google ученый
Wildenradt HL, Singleton VL (1974) Производство ацетальдегида в результате окисления фенольных соединений и его связь со старением вина. Am J Enol Vitic 25: 119–126
CAS Google ученый
Williams VM, Porter LJ, Hemingway RW (1983) Профили молекулярной массы проантоцианидиновых полимеров.Фитохимия 22: 569–572
CAS Google ученый
Williamson G, Stalmach A (2012). Поглощение и метаболизм пищевых хлорогеновых кислот и процианидинов. В: Cheynier V, Sarni-Manchado P, Quideau S (eds) Последние достижения в исследовании полифенолов, том 3. Блэквелл, Лондон (в печати)
Willstätter R, Everest AE (1913) Untersuchungen uber die Anthocyane. I. Uber den Farbstoff der Kornblume. Юстус Либигс Аннален дер Хеми 401: 189–232
Google ученый
Винкель-Ширли Б. (2002) Биосинтез флавоноидов и эффекты стресса.Curr Opinion Plant Biol 5: 218–223
CAS Google ученый
Wirth J, Morel-Salmi C, Souquet JM et al (2010) Влияние воздействия кислорода до и после розлива в бутылки на полифенольный состав красных вин. Food Chem 123: 107–116
CAS Google ученый
Wirth J, Caillé S, Souquet JM et al (2012) Влияние воздействия кислорода после розлива в бутылки на сенсорные характеристики и фенольный состав розовых вин Grenache, Food Chem.Принято в декабре 2011 г.
Войдило А., Ошмиански Дж., Ласковски П. и др. (2008) Полифенольные соединения и антиоксидантная активность новых и старых сортов яблок. J Agric Food Chem 56: 6520–6530
PubMed CAS Google ученый
Wolfender JL, Ndjoko K, Hostettmann K (2001) Потенциал opf LC-ЯМР в фитохимическом анализе. Фитохим Анал 12: 2–22
PubMed CAS Google ученый
Wolfender JL, Ndjoko K, Hostettmann K (2003) Жидкостная хроматография с масс-спектрометрическим детектированием ультрафиолетового поглощения и ядерной магнитно-резонансной спектроскопией: мощная комбинация для он-лайн структурного исследования метаболитов растений.J Chromatogr A 1000: 437–455
PubMed CAS Google ученый
Вольфендер JL, Queiroz EF, Hostettmann K (2005) Фитохимия в области микрограммов — перспектива ЖХ-ЯМР. Magn Reson Chem 43: 697–709
PubMed CAS Google ученый
Wu LC, Prior R (2005a) Систематическая идентификация и характеристика антоцианов с помощью HPLC-ESI-MS / MS в обычных пищевых продуктах в Соединенных Штатах: фрукты и ягоды.J Agric Food Chem 53: 2589–2599
PubMed CAS Google ученый
Wu LC, Prior R (2005b) Идентификация и характеристика антоцианов с помощью высокоэффективной жидкостной хроматографии, электрораспылительной ионизации и тандемной масс-спектрометрии в распространенных пищевых продуктах в Соединенных Штатах: овощах, орехах и зерновых. J Agric Food Chem 53: 3101–3113
PubMed CAS Google ученый
Янагида А., Канда Т., Шоджи Т., Охниши-Камеяма М., Нагата Т. (1999) Фракционирование процианидинов яблока методом эксклюзионной хроматографии.J Chromatogr A 855: 181–190
PubMed CAS Google ученый
Янагида А., Канда Т., Такашаши Т. и др. (2000) Фракционирование процианидинов яблока в зависимости от степени их полимеризации с помощью нормально-фазовой высокоэффективной жидкостной хроматографии. J Chromatogr A 890: 251–259
PubMed CAS Google ученый
Yang Y, Chien M (2000) Характеристика процианидинов винограда с использованием высокоэффективной жидкостной хроматографии / масс-спектрометрии и времяпролетной масс-спектрометрии с лазерной десорбцией / ионизацией с использованием матрицы.J Agric Food Chem 48: 3990–3996
PubMed CAS Google ученый
Йошида К., Ояма К.И., Кондо Т. (2012) Химия флавоноидов в развитии окраски. В: Cheynier V, Sarni-Manchado P, Quideau S (eds) Последние достижения в исследованиях полифенолов, том 3. Blackwell, London
Google ученый
(PDF) Фенольные соединения в растениях: биогенез и функции
17
и их аллелопатические эффекты на Microcystis
Pol J Environ Stud.2011; 20 (5):
1153-1159.
68. Волынец АП. Фенольные соединения в растении
жизнь. Мынск: Беларусь. Навука, 2013. 285 с. (На русском
).
69. Мацумура Э., Мацуда М. Сато Ф., Минами Х.
Микробное производство растительного бензилизохинолина
алкалоидов / Натуральные продукты: фитохимия,
ботаника и метаболизм алкалоидов, фенолов
и терпенов. Рамават К., Мерильон Дж. М.. (Ред.).
Springer, Берлин, Гейдельберг, 2013: 3-24.
70. Купер-Драйвер Г.А., Бхаттачарья М. Роль фенолов
в эволюции растений. Фитохимия.
1998; 49 (5): 1165-1174.
71. Харборн Дж. Б., Уильямс, Калифорния. Успехи в исследованиях
лавоноидов с 1992 года. Фитохимия.
2000; 55 (6): 481-504.
72. Wollenweber E, Stevens JF, Dörr M,
Rozefelds AC. Таксономическое значение вариации авоноидов
у видов умеренного пояса
.Фитохимия. 2003; 62 (7).
Verh Internat Verein Limnol. 2005; 29 (1): 287-
291.
74. Gross EM, Feldbaum C, Graf A. Epiphyte
биомасса и элементный состав на
погруженных макрофитах в мелководных эвтрофных озерах
. 2003; 506 (1–3): 559-565.
75. Schoenaers S, Balcerowicz D, Breen G, Hill K,
Zdanio M, Mouille G, Holman TJ, Oh J,
Wilson MH, Nikonorova N, Vu LD, De Smet I,
Swarup R, De Vos WH, Pintelon I, Adriaensen D,
Gierson C, Bennett MJ, Vissenberg K. Регулируемая ауксином CrRLK1L киназа
ERULUS
контролирует состав клеточной стенки во время роста кончиков корневых волосков
. 2018; 28 (5): 722-732.e6.
76. Браун Д.Е., Рашотт А.М., Мерфи А.С.,
Норманли Дж., Тагу Б.В., Пир В.А., Таиз Л.,
Мудай Г.К. Флавоноиды действуют как негативные регуляторы
транспорта ауксина in vivo у Arabidopsis. Завод
Physiol. 2001; 126 (2): 524-535.
77. Пир В.А., Мерфи А.С. Флавоноиды и ауксин
транспорт: модуляторы или регуляторы? Тенденции
Plant Sci. 2007; 12 (12): 556-563.
78. Сантелия Д., Хенрихс С., Винченцетти В., Зауэр М.,
Биглер Л., Кляйн М., Байли А., Ли Ю., Фримл Дж.,
Гейслер М., Мартиноя Э.Флавоноиды перенаправляют
PIN-опосредованные полярные потоки ауксина во время гравитропных ответов корня
. 2008;
283 (45): 31218-31226.
79. Ng JL, Hassan S, Truong TT, Hocart CH,
Laont C, Frugier F, Mathesius U. Флавоноиды
и ингибиторы транспорта ауксина спасают симбиотические
клубеньки в Цитокинин
мутант восприятия cre1. 2015; 27 (8):
2210-2226.
80. Besseau S, Homann L, Georoy P, Lapierre C,
Pollet B, Legrand M. Накопление флавоноидов в
Arabidopsis, подавленное в синтезе лигнина, влияет на
транспорт ауксина и рост растений.
2007; 19 (1): 148-162.
81. Ян Т., Чен И, Ван Х-Х, Дай Ц-С. Растение
симбионтов: ключи к фитосфере. Симбиоз.
2013; 59 (1): 1-14.
82. Whipps JM. Микробные взаимодействия и
биоконтроль в ризосфере. 2001;
52 (выпуск спецификации): 487-511.
83. Bais HP, Park SW, Weir TL, Callaway RM,
Vivanco JM. Как растения общаются по подземной информационной супермагистрали
. Тенденции
Plant Sci. 2004; 9 (1): 26-32.
84. Дакора Ф.Д., Филипс Д.А. Экссудаты корней
как медиаторы поглощения минералов в средах с низким содержанием питательных веществ
. Почва растений. 2002; 245 (1): 35-47.
85. Бхаттачарья А., Суд П., Цитовски В.Роль
фенольных соединений растений в защите и коммуникации
во время инфекции и Rhizobium.
Mol Plant Pathol. 2010; 11 (5): 705-719.
86. Hartley RD, Harris PJ. Фенольные составляющие
клеточных стенок двудольных растений. Biochem Syst
Ecol. 1981; 9 (2-3): 189-203.
87. Блюм У., Стаман К.Л., Флинт Л.Дж., Стивен Р. Индукция и / или выбор феноловой кислоты с использованием
почвенных и ризосферных бактерий и их
влияние на фитотоксичность фенольной кислоты.
Ecol. 2000; 26 (9): 2059-2078.
88. Hättenschwiler S, Vitousek PM. Роль полифенолов
в круговороте питательных веществ наземных экосистем
. Trends Ecol Evol. 2000; 15 (6): 238-243.
89. Тейлор Л.П., Гротевольд Э. Флавоноиды как
регуляторы развития.
2005; 8 (3): 317-323.
90. Хассан С., Матезиус У. Роль тавоноидов
в передаче сигналов корневого ризосферы: возможности
и проблемы для улучшения взаимодействия растений и микробов
.201; 63 (9): 3429-3444.
91. Халворсон Дж. Дж., Гонсалес Дж. М., Хагерман А. Е.,
Смит Дж. Л.. Сорбция танина и родственного фенола
Л. М. Бабенко, О. Е. Смирнов, К. О. Романенко и др.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Фенольные соединения в растениях: биогенез и функции
Ukr.Biochem.J. 2019; Том 91, выпуск 3, май-июнь, стр. 5-18
doi: https://doi.org/10.15407/ubj91.03.005
Фенольные соединения в растениях: биогенез и функции
Л.Бабенко М. 1 , Смирнов О. Е. 2 , Романенко К. О. 1 ,
Трунова О. К. 3 , Косаковская И. В. 1
1 M.G. Институт ботаники им. Холодного НАН Украины, Киев;
2 Учебно-научный центр «Институт биологии и медицины» Киевского национального университета имени Тараса Шевченко, Украина;
3 В.И. Институт общей и неорганической химии им. Вернадского, НАН Украины, Киев;
эл.почта: лилия[email protected]
Поступила: 05.11.2018; Принято: 14 марта 2019
Фенольные соединения (ФС) в растениях играют важную роль в контроле роста и обладают антиоксидантными, структурными, аттрактантными, сигнальными и защитными функциями. Проанализированы и обобщены сведения об открытии, изучении и идентификации фенольных соединений в растениях, их роли в сложной системе вторичных метаболитов. Описаны функции ПК на макромолекулярном, клеточном, а также на уровне организма и популяции.Выделены пути образования ПК, ферменты, ответственные за их синтез, и пластичность синтеза в растительной клетке. Обсуждается участие ПК в дыхании растений, фотосинтезе, окислительно-восстановительных процессах и регуляции физиологического состояния растений.
Ключевые слова: биогенез, фенольные соединения, фенилаланин, фенилаланинаммиаклиаза, физиологическая роль
Литература:
- Прусакова Л.Д., Кефели В.И., Белопухов С.Л., Вакуленко В.В., Кузнецова С.А.Роль фенольных соединений в растениях. Агрохимия. 2008; 7: 86-96. (На русском).
- Запрометов М.Н. Фенольные соединения и их роль в жизни растения: 56-е Тимирязевские чтения. М .: Наука, 1996. 45 с. (На русском).
- Хлесткина Э.К. Адаптивная роль флавоноидов: акцент на злаках. Cereal Res Commun. 2013; 41 (2): 185-198. CrossRef
- Запрометов М.Н., Николаева Т.Н. Хлоропласты, выделенные из листьев фасоли, способны к биосинтезу фенольных соединений. Russ J Plant Physiol. 2003; 50 (5): 623-626. CrossRef
- Золотарева О.К., Подорванов В.В., Дубина Д.В. Полифенольные соединения макрофитов и их экологическое значение. Укр Бот Дж. 2017; 74 (4): 373–384. (На украинском языке). CrossRef
- Balasundram N, Sundram K, Samman S. Фенольные соединения в растениях и побочных продуктах сельского хозяйства: антиоксидантная активность, наличие и потенциальное использование. Food Chem. 2006; 99 (1): 191-203. CrossRef
- Ковалева Л.В., Захарова Е.В., Минкина Ю.В.Ауксин и флавоноиды в прогемной фазе оплодотворения петунии. Russ J Plant Physiol. 2007; 54 (3): 396-401. CrossRef
- Vanholme R, Demedts B, Morreel K, Ralph J, Boerjan W. Биосинтез и структура лигнина. Plant Physiol. июль 2010 г .; 153 (3): 895-905. PubMed, PubMedCentral, CrossRef
- Amthor JS. Эффективность биосинтеза лигнина: количественный анализ. Энн Бот. Май 2003 г .; 91 (6): 673-95. PubMed, PubMedCentral, CrossRef
- Крозье А., Джаганатх И.Б., Клиффорд М.Н. Фенолы, полифенолы и дубильные вещества: обзор / Вторичные метаболиты растений: наличие, структура и роль в рационе человека; Крозье А., Клиффорд М., Ашихара Х. Редакторы. Блэквелл: Оксфорд, Великобритания, 2008: 1-24. CrossRef
- Хартманн Т. От отходов к экохимическим веществам: пятьдесят лет исследований вторичного метаболизма растений. Фитохимия. ноябрь-декабрь 2007 г .; 68 (22-24): 2831-46. PubMed, CrossRef
- Koukol J, Conn EE. Метаболизм ароматических соединений у высших растений.IV. Очистка и свойства фенилаланиндезаминазы Hordeum vulgare. J Biol Chem. Октябрь 1961 г .; 236: 2692-8. PubMed
- Sachs, J. Handbuch der Experiment-Physiologie der Pflanzen. Вильгельм Энгельманн, Лейпциг, Германия, 1865. 514 с.
- Knaggs AR. Биосинтез метаболитов шикимата. Nat Prod Rep. 2003 Февраль; 20 (1): 119-36. PubMed, CrossRef
- Винкель-Ширли Б. Биосинтез флавоноидов и эффекты стресса. Curr Opin Plant Biol. Июнь 2002; 5 (3): 218-23. PubMed, CrossRef
- Hahlbrock K, Scheel D. Физиология и молекулярная биология метаболизма фенилпропаноидов. Ann Rev Plant Physiol Plant Mol Biol. 1989; 40 (1): 347–369. CrossRef
- Блаунт Дж. У., Корт К. Л., Масуд С. А., Расмуссен С., Лэмб С., Диксон Р. А.. Изменение экспрессии 4-гидроксилазы коричной кислоты в трансгенных растениях свидетельствует о наличии петли обратной связи в точке входа в фенилпропаноидный путь. Физиология растений . 2000 Янв; 122 (1): 107-16.PubMed, PubMedCentral, CrossRef
- Оллвуд Е.Г., Дэвис Д.Р., Герриш К., Эллис Б.Э., Болвелл Г.П. Фосфорилирование фенилаланинаммиаклиазы: доказательства новой протеинкиназы и идентификация фосфорилированного остатка. FEBS Lett. 1999 20 августа; 457 (1): 47-52. PubMed, CrossRef
- Cheng SH, Sheen J, Gerrish C, Bolwell GP. Молекулярная идентификация фенилаланинаммиаклиазы как субстрата специфической конститутивно активной CDPK Arabidopsis, экспрессируемой в протопластах кукурузы. FEBS Lett. 17 августа 2001; 503 (2-3): 185-8. PubMed, CrossRef
- Gälweiler L, Guan C, Müller A, Wisman E, Mendgen K, Yephremov A, Palme K. Регулирование полярного транспорта ауксина с помощью AtPIN1 в сосудистой ткани Arabidopsis. Наука. 18 декабря 1998; 282 (5397): 2226-30. PubMed, CrossRef
- Dai J, Mumper RJ. Растительные фенолы: экстракция, анализ, их антиоксидантные и противораковые свойства. Molecules. 21 октября 2010 г .; 15 (10): 7313-52. PubMed, PubMedCentral, CrossRef
- Gómez-García Mdel R, Очоа-Алехо Н.Биохимия и молекулярная биология биосинтеза каротиноидов в перце чили (Capsicum spp.). Int J Mol Sci. 2013 16 сентября; 14 (9): 19025-53. PubMed, PubMedCentral, CrossRef
- Palladin W. Das Blut der Pflanzen. Berichte der Deutschen Botanischen Gesellschaft. 1908; 26а: 125-132.
- Раванель П., Тиссут М., Дус Р. Разобщающая активность халконов и дигидрохалконов на изолированных митохондриях клубней картофеля и гипокотилей маша. Фитохимия. 1982; 21 (12): 2845-2850.CrossRef
- Zhao HJ, Zou Q. Защитные эффекты экзогенных антиоксидантов и фенольных соединений на фотосинтез листьев пшеницы при высокой освещенности и окислительном стрессе. Photosynthetica. 2002; 40 (4): 523-527. CrossRef
- Ylstra B, Touraev A, Moreno RM, Stöger E, van Tunen AJ, Vicente O, Mol JN, Heberle-Bors E. Флавонолы стимулируют развитие, прорастание и рост пыльцы табака в трубках. Plant Physiol. Октябрь 1992 г .; 100 (2): 902-7. PubMed, PubMedCentral, CrossRef
- van der Meer IM, Stam ME, van Tunen AJ, Mol JN, Stuitje AR.Антисмысловое подавление биосинтеза флавоноидов в пыльниках петунии приводит к мужскому бесплодию. Растительная клетка. , март 1992 г .; 4 (3): 253-62. PubMed, PubMedCentral, CrossRef
- Мо Ю., Нагель С., Тейлор Л. П.. Биохимическая комплементарность мутантов халконсинтазы определяет роль флавонолов в функциональной пыльце. Proc Natl Acad Sci USA. , 1 августа 1992 г .; 89 (15): 7213-7. PubMed, PubMedCentral, CrossRef
- Pollak PE, Vogt T, Mo Y, Taylor LP. Накопление халкон-синтазы и флавонолов в стигмах и пыльниках Petunia hybrida. Plant Physiol. , июль 1993 г .; 102 (3): 925-932. PubMed, PubMedCentral, CrossRef
- Бурьян В., Ральф Дж., Баучер М. Биосинтез лигнина. Annu Rev Plant Biol. 2003; 54: 519-46. PubMed, CrossRef
- Риверо Р.М., Руис Дж. М., Гарсия П. К., Лопес-Лефебре Л. Р., Санчес Э., Ромеро Л. Устойчивость к холоду и тепловому стрессу: накопление фенольных соединений в растениях томатов и арбузов. Plant Sci. , 5 января 2001 г .; 160 (2): 315-321. PubMed, CrossRef
- Król A, Amarowicz R, Weidner S.Влияние холодового стресса на фенольные соединения и антиоксидантную способность листьев виноградной лозы (Vitis vinifera L.). J Plant Physiol. 15 сентября 2015; 189: 97-104. PubMed, CrossRef
- Amarowicz R, Weidner S, Wójtowicz I, Karmać M, Kosińska A, Rybarczyk A. Влияние низкотемпературного стресса на изменение состава фенольных соединений листьев виноградной лозы и их антиоксидантные свойства. Funct Plant Sci Biotechnol. 2010; 4: 90–96.
- Weidner S, Karolak M, Karamać M., Амарович Р. Фенольные соединения и свойства антиоксидантов в корнях виноградной лозы (Vitis vinifera) в условиях стресса засухи с последующим выздоровлением. Acta Soc Bot Pol. 2009; 78 (2): 97–103. CrossRef
- Диксон Р.А., Ахнин Л., Кота П., Лю С.Дж., Редди М.С., Ван Л. Путь фенилпропаноидов и защита растений — перспектива геномики. Мол Растение Патол. 1 сентября 2002; 3 (5): 371-90. PubMed, CrossRef
- Swigonska S, Amarowicz R, Król A, Mostek A, Badowiec A, Weidner S. Влияние абиотического стресса во время прорастания сои с последующим восстановлением фенольных соединений корешков и их антиоксидантной способности. Acta Soc Bot Pol. 2014; 83 (3): 209–218. CrossRef
- Рудиковская Е.Г., Федорова Г.А., Дударева Л.В., Макарова Л.Е., Рудоковский А.В. Влияние температуры роста на состав фенолов в корнях гороха. Russ J Plant Physiol. 2008; 55 (5): 712–715. CrossRef
- Посмык М.М., Байли С., Шафранска К., Янас К.М., Корбино Ф. Антиоксидантные ферменты и изофлавоноиды в охлажденных саженцах сои (Glycine max (L.) Merr.). J Plant Physiol. , апрель 2005 г .; 162 (4): 403-12.PubMed, CrossRef
- Олениченко Н.А., Загоскина Н.В., Астахова Н.В., Трунова Т.И., Кузнецов Ю.В. Первичный и вторичный метаболизм озимой пшеницы при закаливании и обработке антиоксидантами. Appl Biochem Microbiol. , сентябрь-октябрь 2008 г .; 44 (5): 589-94. (На русском). PubMed, CrossRef
- Шичиджо К., Хамада Т., Хираока М., Джонсон С.Б., Хашимото Т. Усиление синтеза антоцианов, индуцированного красным светом, в первых междоузлиях сорго за счет умеренно низкой температуры в период культивирования до облучения. Планта . 1993; 191 (2): 238–245. CrossRef
- Кристи П.Дж., Альфенито М.Р., Уолбот В. Влияние низкотемпературного стресса на общие пути фенилпропаноидов и антоцианов: увеличение количества транскриптов и пигментации антоцианов в проростках кукурузы. Planta. 1994; 194 (4): 541–549. CrossRef
- Гоулд К.С., Листер С. Функции флавоноидов в растениях / Флавоноиды: химия, биохимия и приложения. Ред. О.М. Андерсен, К. Маркхэм. Тейлор и Фрэнсис Групп, ООО.2006: 397-442. CrossRef
- Паулючкова С.М., Спивак Е.А., Вершиловская И.В. Недвед Е.Л. Влияние экзогенной 5-аминолевулиновой кислоты на работу антиоксидантной системы растений картофеля (Solanum tuberosum) в условиях низкотемпературного стресса. Proc Nat Acad Sci Belarus. Biol Ser. 2014; 3: 46-51. (На русском).
- Олениченко Н.А., Загоскина Н.В., Астахова Н.В., Трунова Т.И., Кузнецов Ю.В. Первичный и вторичный метаболизм озимой пшеницы при закаливании и обработке антиоксидантами. Appl Biochem Microbiol. 2008; 44 (5): 535-540. CrossRef
- Абрамчик Л.М., Сердюченко Е.В., Макаров В.Н., Зеневич Л.А., Жаворонкова Н.Б., Кабашникова Л.Ф. Сортовые особенности реакции гексаплоидного тритикале весеннего на термическое напряжение. Proc Nat Acad Sci Belarus. Biol Ser. 2014; 4: 43-49. (На русском).
- Кабашникова Л.Ф., Абрамчик Л.М., Сердюченко Е.В., Капылова Л.В. Различают действие проростков ячменя (Hordeum vulgare) с комбинированным действием гипертермии и обезвоживания. Proc Nat Acad Sci Belarus. Biol Ser. 2013; 3: 60–65. (На русском).
- Чалкер-Скотт Л. Экологическое значение антоциана в ответных реакциях растений на стресс. Photochem Photobiol. 1999; 70 (1): 1–9. CrossRef
- Gould KS, Markham KR, Smith RH, Goris JJ. Функциональная роль антоцианов в листьях Quintinia serrata A. Cunn. J Exp Bot. 2000 июн; 51 (347): 1107-15. PubMed, CrossRef
- Harvaux M, Kloppstech K. Защитные функции каротиноидных и флавоноидных пигментов против избыточного видимого излучения при температуре охлаждения исследованы на мутантах Arabidopsis npq и tt . Planta. Октябрь 2001 г .; 213 (6): 953-66. PubMed, CrossRef
- Колупаев Ю.Е., Ястреб Т.О., Обозный А.И., Рябчун Н.И., Кириченко В.В. Конститутивная и холодовая устойчивость проростков ржи и пшеницы к окислительному стрессу. Russ J Plant Physiol. 2016; 63 (3): 326–337. CrossRef
- Лахман Дж., Дуджак Дж., Михолова Д., Колиховас Д., Пивец В. Влияние кадмия на содержание флавоноидов в молодых растениях ячменя ( Hordeum sativum L.). Plant Soil Environ. 2005; 51 (11): 513–516.CrossRef
- Schmidt S, Zietz M, Schreiner M, Rohn S, Kroh LW, Krumbein A. Генотипические и климатические влияния на концентрацию и состав флавоноидов в капусте капусты ( Brassica oleracea var. sabellica ). Food Chem . 2010; 119 (4): 1293–1299. CrossRef
- Treutter D. Значение флавоноидов в устойчивости растений: обзор. Environ Chem Lett. 2006; 4 (3): 147–157. CrossRef
- Бабенко Л.М., Водка М.В., Акимов Ю.Н., Смирнов А.Е., Бабенко А.В., Косаковская И.И. Особенности ультраструктуры и биохимического состава клеток листового мезофилла Triticum spel ta L.в начальный период стресс-температурного воздействия. Cell Tissue Biol. 2019; 13 (1): 70-78. CrossRef
- Колупаев Ю.Е., Хориелова Е.И., Ястреб Т.О., Попов Ю.В., Рябчун Н.И. Активность фенилаланинаммиаклиазы и содержание флавоноидных соединений в проростках пшеницы при действии гипотермии и донора сероводорода. Укр Биохим Дж. 2018; 90 (6): 12-20. CrossRef
- Hectors K, van Oevelen S, Guisez Y, Prinsen E, Jansen MA. Фитогормон ауксин является компонентом регуляторной системы, которая контролирует УФ-опосредованное накопление флавоноидов и УФ-индуцированный морфогенез. Physiol Plant. , август 2012 г .; 145 (4): 594-603. PubMed, CrossRef
- Мерфи TM, Гамильтон CM. Штамм Rosa damascena культивирует клетки, устойчивые к ультрафиолетовому излучению. Plant Physiol. декабрь 1979 г .; 64 (6): 936-41. PubMed, PubMedCentral, CrossRef
- Кондо Н., Кавашима М. Повышение устойчивости к окислительному стрессу у проростков огурца ( Cucumis sativus L.) при УФ-В облучении: возможное участие фенольных соединений и антиоксидантных ферментов. J Plant Res. 2000; 113 (3): 311–317. CrossRef
- Ou S, Lu S, Yang S. Влияние усиленного УФ-B излучения на содержание фавоноидов в клетках мезофилла пшеницы. Imaging Radiat Res. 2018; 1 (1): 1–9. CrossRef
- Блохина О., Виролайнен Э., Фагерстедт К.В. Антиоксиданты, окислительное повреждение и кислородный стресс: обзор. Энн Бот . 2003 Январь; 91 Спец. №: 179-94.
PubMed, PubMedCentral, CrossRef - Радюкина Н.Л., Тоайма ВИМ, Зарипова Н.Р.Участие низкомолекулярных антиоксидантов в кросс-адаптации лекарственных растений к последовательному действию УФ-В излучения и засоления. Russ J Plant Physiol. 2012; 59 (1): 71–78. CrossRef
- Punyasiri PA, Abeysinghe SB, Kumar V. Преформированная и индуцированная химическая устойчивость чайного листа против инфекции Exobasidium vexans . J Chem Ecol. 2005 июн; 31 (6): 1315-24. PubMed, CrossRef
- Яо К., Де Лука В., Бриссон Н. Создание метаболического приемника триптофана изменяет путь фенилпропаноидов и восприимчивость картофеля к Phytophthora infestans. Растительная клетка . 1995 ноябрь; 7 (11): 1787-1799. PubMed, PubMedCentral, CrossRef
- Beckman CH. Клетки, накапливающие фенолы: ключи к запрограммированной гибели клеток и формированию перидермы при устойчивости к заболеванию вилта и в общих защитных реакциях растений? Physiol Mol Plant Pathol. 2000; 57 (3): 101-110. CrossRef
- Лозовая В.В., Лыгин А.В., Зернова О.В., Ли С., Хартман Г.Л., Видхольм Дж. Накопление изофлавоноидов в волосатых корнях сои при обработке Fusarium solani. Plant Physiol Biochem. июль-август 2004 г .; 42 (7-8): 671-9. PubMed, CrossRef
- Дмитриев АП. Фитоалексины и их роль в устойчивости растений. НАН Украины, Институт клеточной биологии и генной инженерии. Киев: Наукова думка, 1999. 207 с. (На русском).
- Гао И.Н., Лю BY, Сюй Д., Чжоу QH, Ху Си, Ге Ф.Дж., Чжан Л.П., Ву З.Б. Фенольные соединения, выделяемые двумя погруженными в воду пресноводными макрофитами, и их аллелопатические эффекты на Microcystis aeruginosa. Pol J Environ Stud. 2011; 20 (5): 1153-1159.
- Волынец АП. Фенольные соединения в растительной жизни. Мынск: Беларусь. навука, 2013. 285 с. (На русском).
- Мацумура Э., Мацуда М. Сато Ф., Минами Х. Микробное производство растительных бензилизохинолиновых алкалоидов / Натуральные продукты: фитохимия, ботаника и метаболизм алкалоидов, фенолов и терпенов. Рамават К., Мерильон Дж. М.. (Ред.). Springer, Берлин, Гейдельберг, 2013: 3-24. CrossRef
- Купер-Драйвер Г.А., Бхаттачарья М. Роль фенольных соединений в эволюции растений. Фитохимия. 1998; 49 (5): 1165-1174.
- Harborne JB, Уильямс, Калифорния. Успехи в исследовании флавоноидов с 1992 года. Фитохимия. Ноябрь 2000; 55 (6): 481-504. PubMed, CrossRef
- Wollenweber E, Stevens JF, Dörr M, Rozefelds AC. Таксономическое значение изменчивости флавоноидов у видов Nothofagus умеренного пояса. Фитохимия. Апрель 2003; 62 (7): 1125-31. PubMed, CrossRef
- Эрхард Д., Гросс Э. Влияют ли факторы окружающей среды на состав потенциальных аллелохимических веществ в подводном пресноводном макрофите Elodea nuttallii (Hydrocharitaceae)? Verh Internat Verein Limnol. 2005; 29 (1): 287–291. CrossRef
- Гросс Е.М., Фельдбаум С., Граф А. Биомасса и элементный состав эпифитов на погруженных макрофитах в неглубоких эвтрофных озерах. Hydrobiologia. 2003; 506 (1–3): 559–565. CrossRef
- Schoenaers S, Balcerowicz D, Breen G, Hill K, Zdanio M, Mouille G, Holman TJ, Oh J, Wilson MH, Nikonorova N, Vu LD, De Smet I, Swarup R, De Vos WH, Pintelon I, Adriaensen D , Грирсон С., Беннетт М.Дж., Виссенберг К. Регулируемая ауксином киназа CrRLK1L ERULUS контролирует состав клеточной стенки во время роста кончиков корневых волосков. Curr Biol. 5 марта 2018 г .; 28 (5): 722-732.e6. PubMed, CrossRef
- Браун Д.Е., Рашотт А.М., Мерфи А.С., Норманли Дж., Тагу Б.В., Пир В.А., Таиз Л., Мудай Г.К. Флавоноиды действуют как негативные регуляторы транспорта ауксина in vivo у арабидопсиса. Plant Physiol. июнь 2001; 126 (2): 524-35. PubMed, PubMedCentral, cr id = ”https://doi.org/10.1104/pp.126.2.524 ″]
- Peer WA, Murphy AS. Транспорт флавоноидов и ауксина: модуляторы или регуляторы? Trends Plant Sci. Декабрь 2007 г .; 12 (12): 556-63.PubMed, CrossRef
- Santelia D, Henrichs S, Vincenzetti V, Sauer M, Bigler L, Klein M, Bailly A, Lee Y, Friml J, Geisler M, Martinoia E. Флавоноиды перенаправляют опосредованные PIN полярные потоки ауксина во время корневых гравитропных реакций. J Biol Chem. , 7 ноября 2008 г .; 283 (45): 31218-26. PubMed, PubMedCentral, CrossRef
- Ng JL, Hassan S, Truong TT, Hocart CH, Laffont C, Frugier F, Mathesius U. Флавоноиды и ингибиторы транспорта ауксина спасают симбиотическую нодуляцию в мутанте рецепции цитокинина Medicago truncatula cre1 . Растительная клетка. 2015 августа; 27 (8): 2210-26. PubMed, PubMedCentral, CrossRef
- Besseau S, Hoffmann L, Geoffroy P, Lapierre C, Pollet B, Legrand M. Накопление флавоноидов в Arabidopsis, подавленное при синтезе лигнина, влияет на транспорт ауксина и рост растений. Растительная клетка. Январь 2007; 19 (1): 148-62. PubMed, PubMedCentral, CrossRef
- Ян Т., Чен И, Ван Х-Х, Дай Ц-С. Растительные симбионты: ключи к фитосфере. Симбиоз. 2013; 59 (1): 1-14. CrossRef
- Whipps JM.Микробные взаимодействия и биоконтроль в ризосфере. J Exp Bot. марта 2001 г .; 52 (выпуск спецификации): 487-511. PubMed, CrossRef
- Bais HP, Park SW, Weir TL, Callaway RM, Vivanco JM. Как растения общаются по подземной информационной супермагистрали. Trends Plant Sci. Январь 2004; 9 (1): 26-32. PubMed, CrossRef
- Dakora FD, Phillips DA. Экссудаты корней как медиаторы накопления минералов в средах с низким содержанием питательных веществ. Почва растений . 2002; 245 (1): 35–47.CrossRef
- Бхаттачарья А., Суд П., Цитовски В. Роль фенольных соединений растений в защите и коммуникации во время инфицирования Agrobacterium и Rhizobium . Мол Растение Патол. сен 2010; 11 (5): 705-19. PubMed, CrossRef
- Хартли Р.Д., Харрис П.Дж. Фенольные составляющие клеточных стенок двудольных. Biochem Syst Ecol. 1981; 9 (2-3): 189-203. CrossRef
- Блюм У., Стаман К.Л., Флинт Л.Дж., Стивен Р. Индукция и / или отбор феноловой кислоты с использованием почвенных и ризосферных бактерий и их влияние на фитотоксичность фенольной кислоты. J Chem Ecol. 2000; 26 (9): 2059–2078. CrossRef
- Hättenschwiler S, Vitousek PM. Роль полифенолов в круговороте питательных веществ наземных экосистем. Trends Ecol Evol. 2000 июн; 15 (6): 238-243. PubMed, CrossRef
- Тейлор Л.П., Гротевольд Э. Флавоноиды как регуляторы развития. Curr Opin Plant Biol. июн 2005 г .; 8 (3): 317-23. PubMed, CrossRef
- Hassan S, Mathesius U. Роль флавоноидов в передаче сигналов корневого ризосферы: возможности и проблемы для улучшения взаимодействия растений и микробов. J Exp Bot. Май 2012; 63 (9): 3429-44. PubMed, CrossRef
- Halvorson JJ, Gonzalez JM, Hagerman AE, Smith JL. Сорбция танина и родственных фенольных соединений и влияние на растворимый азот в почве. Soil Biol Biochem. 2009; 41 (9): 2002–2010. CrossRef
- Кефели В.И., Калевич М.В., Борсари Б. Фенольный цикл в растениях и окружающей среде. J Cell Mol Biol. 2003; 2 (1): 13–18.
- Мандал С.М., Чакраборти Д., Дей С. Фенольные кислоты действуют как сигнальные молекулы в симбиозах растений и микробов. Plant Signal Behav. , апрель 2010 г .; 5 (4): 359-68.
PubMed, PubMedCentral, CrossRef - Mierziak J, Kostyn K, Kulma A. Флавоноиды как важные молекулы взаимодействия растений с окружающей средой. Molecules. 10 октября 2014 г .; 19 (10): 16240-65.
PubMed, PubMedCentral, CrossRef - Стаман К., Блюм У., Лоус Ф., Робертсон Д. Может ли одновременное подавление роста проростков и стимуляция популяций ризосферных бактерий служить доказательством переноса фитотоксинов из растительных остатков в основной массе почвы в ризосферу чувствительных видов? J Chem Ecol. 2001 апр; 27 (4): 807-29. PubMed, CrossRef
- Hartwig UA, Joseph CM, Phillips DA. Флавоноиды, высвобождаемые естественным образом из семян люцерны, увеличивают скорость роста Rhizobium meliloti . Plant Physiol. Март 1991 г .; 95 (3): 797-803. PubMed, PubMedCentral, CrossRef
- Kobayashi H, Naciri-Graven Y, Broughton WJ, Perret X. Флавоноиды вызывают временные сдвиги в экспрессии генов локусов, контролируемых nod-box, в Rhizobium sp. NGR234. Mol Microbiol. Январь 2004; 51 (2): 335-47.PubMed, CrossRef
- Janczarek M, Rachwał K, Marzec A, Grządziel J, Palusinska-Szysz M. Сигнальные молекулы и компоненты клеточной поверхности, участвующие в ранних стадиях взаимодействия бобовых и ризобий. Appl Soil Ecol. 2014; 85: 94–113. CrossRef
- Fox JE, Starcevic M, Kow KY, Burow ME, McLachlan JA. Фиксация азота. Эндокринные разрушители и передача сигналов флавоноидов. Природа. 13 сентября 2001; 413 (6852): 128-9. PubMed, CrossRef
- Steinkellner S, Lendzemo V, Langer I, Schweiger P, Khaosaad T, Toussaint JP, Vierheilig H.Флавоноиды и стриголактоны в корневых экссудатах как сигналы в симбиотических и патогенных взаимодействиях растений и грибов. Molecules. 5 июля 2007 г .; 12 (7): 1290-306. PubMed, PubMedCentral, CrossRef
- Понсе MA, Scervino JM, Erra-Balsells R, Ocampo JA, Godeas AM. Флавоноиды из побегов и корней Trifolium repens (клевер белый), выращенный в присутствии или в отсутствие гриба арбускулярной микориз Glomus intraradices . Фитохимия. Июль 2004; 65 (13): 1925-30.PubMed, CrossRef
- Акияма К., Мацуока Х., Хаяси Х. Выделение и идентификация вызванного дефицитом фосфата C-гликозилфлавоноида, который стимулирует образование арбускулярной микоризы в корнях дыни. Mol Plant Microbe Interact. 2002; 15 (4): 334–340. CrossRef
- Schliemann W, Ammer C, Strack D. Профилирование метаболитов микоризных корней Medicago truncatula . Фитохимия. Январь 2008 г .; 69 (1): 112-46. PubMed, CrossRef
- Харрисон MJ, Диксон RA.Накопление изофлавоноидов и экспрессия транскриптов защитных генов во время установления везикулярных арбускулярных микоризных ассоциаций в корнях Medicago truncatula . Mol Plant Microbe Interact. 1993; 6 (5): 643–654. CrossRef
- Харрисон MJ, Диксон RA. Пространственные паттерны экспрессии генов флавоноидного / изофлавоноидного пути во время взаимодействия между корнями Medicago truncatula и микоризным грибом Glomus versiforme . Plant J. 1994; 6 (1): 9–20. CrossRef
- Lagrange H, Jay-Allemand C, Lapeyrie F. Рутин, фенолгликозид из экссудатов корней эвкалипта, стимулирует рост гифов Pisolithus при пикомолярных концентрациях. New Phytol. 2001; 149 (2): 349–355. CrossRef
- Scervino JM, Ponce MA, Erra-Bassells R, Vierheilig H, Ocampo JA, Godeas A. Колонизация томатов арбускулярной микоризой видами Gigaspora и Ø в присутствии корневых флавоноидов. J Plant Physiol. июнь 2005 г .; 162 (6): 625-33. PubMed, CrossRef
- Хакобо-Веласкес Д.А., Сиснерос-Зеваллос Л. Последние достижения в области растительных фенолов. Molecules. 2017; 22 (8): 1249. CrossRef
- Cartea ME, Francisco M, Soengas P, Velasco P. Фенольные соединения в овощах brassica. Molecules. 2011; 16 (1): 251–280. CrossRef
.
Влияние климатических изменений на фенольный состав и антиоксидантную способность популяций Medicago minima
В ходе настоящего исследования вторичные метаболиты были изучены в M.minima , чтобы подчеркнуть их фенольный потенциал и идентифицировать некоторые из их фенольных соединений, уже приобретенных в качестве основы для лекарств или продуктов питания и кормов. Мы установили фенольный состав четырех органов в 12 тунисских популяциях M. minima из засушливых и полузасушливых регионов и оценили их антиоксидантную активность.
Распределение фенольных соединений в органах растений и их антиоксидантная способность
Полученные результаты показывают, что M.Minima корни, стебли, листья и семена выделили различные уровни TPC, TFC и общей антиоксидантной способности. Об этой изменчивости также сообщалось у Medicago sativa и Cynara cardunculus L. 26,27 . Сосредоточившись на двух видах Medicago , M. minima имеет более высокий TPC по сравнению с M. sativa , который получил большие преимущества в агропромышленности 24 . Однако орган с самым высоким содержанием фенола в M.Minima — это листья, тогда как семена являются самым богатым органом в M. sativa 26 . Как и многие другие виды ( C. cardunculus L. и M. sativa ), семена M. minima имели самое высокое общее содержание флавоноидов по сравнению со всеми частями растения 26,28 . Однако у M. minima листья содержали больше TFC по сравнению с корнями и стеблями, в отличие от M. sativa 26 . Следовательно, существует разница в распределении фенольных соединений в органах растений соседних и несоседних видов 24,25,26,27,28 .Кроме того, большая вариабельность TFC в корнях может отражать взаимодействие между растениями M. minima и их окружающей средой (почвой). Как сигнальные молекулы, флавоноиды играют важную роль в стимулировании образования узлов в клетках корней симбиотическими бактериями, широко известными как ризобии 29,30 . Флавоноиды широко распространены у всех бобовых племен. Они вмешиваются в связь между окружающей средой и растением, включая противомикробные, противозачаточные и антиоксидантные эффекты 31 .Таким образом, тот факт, что самая высокая антиоксидантная способность была обнаружена у семян и листьев M. minima , предполагает, что накопление флавоноидов в надземных органах M. minima является частью их защитной стратегии.
Как мы уже упоминали ранее, растения M. minima накапливают фенольные и флавоноидные соединения в своих листьях и семенах больше, чем в других органах. Таким образом, изучение фенольного состава каждого органа брюк позволило нам четко понять эту вариацию.Наш анализ ВЭЖХ выявил 70% проверенных фенольных соединений. Профили ВЭЖХ подтвердили, что корни и семена представляют собой самые богатые органы. Основные соединения, такие как галловая кислота, лютеолин и кверцетин, присутствовали в органах растений M. minima со средней концентрацией выше 250 мкг / г СВ. Тем не менее, второстепенные соединения, а именно феруловая кислота, рутин, синаповая кислота и сиринговая кислота, имели среднюю концентрацию менее 300 мкг / г СВ. Такие фенольные соединения вызывают значительный интерес в агропромышленности 17 , а также в медицине 15,18,19 .Их также можно использовать в качестве противомикробных добавок и антиоксидантов в пищевой промышленности, особенно галловую кислоту, которая, как считается, обладает хорошими свойствами для придания сладости 17 . Почти все основные и второстепенные соединения доступны в корнях M. minima , за исключением рутина. Все соединения показали большой разброс в пределах корней M. minima . Эти соединения чрезвычайно важны, потому что они выполняют различные функции в симбиозе (взаимодействия растений с микробами), который влияет на рост ризобий 29,30 .Различия в фенольном составе между частями растений подчеркиваются наличием галловой кислоты только в корнях и сиринговой кислоты только в экстрактах корней и листьев. Сообщается, что в клубеньках сои галловая кислота действует как первичный антиоксидант 30 . Тем не менее, в корневых экссудатах дуба каменного ( Quercus ilex ) метаболизм галловой кислоты активируется и деактивируется в ответ на стресс, вызванный засухой 32 . Наши результаты согласуются с этим предыдущим наблюдением, в котором использовался стресс от засухи.Изменчивость между частями растений подчеркивалась наличием рутина только в надземных органах растений. M. minima стебли и листья показали те же идентифицированные фенольные соединения 33 , за исключением сиреневой кислоты; это несоответствие составляет различие между этими двумя воздушными органами. Эти соединения (рутин и сиринговая кислота) также были обнаружены в надземных органах Medicago truncatula 33 . Более того, экстракты листьев M. minima содержали рутин и сиринговую кислоту, которые отсутствуют в M.sativa экстракты листьев 26,34 . Рутин является одним из важных компонентов яблок и обладает множеством фармакологических активностей с широким спектром биологических активностей 35 . Точно так же сиринговая кислота была описана как потенциальное фармацевтическое соединение, которое обладает способностью модулировать активность ферментов, динамику белков и различные факторы транскрипции, которые участвуют в диабете, воспалении, ангиогенезе и раке 22 . Наши результаты подчеркивают разницу между родом Medicago и важность M.minima , особенно в сфере продуктов питания и других сферах интересов 21,22,24,25,35,36 . Кроме того, присутствие феруловой кислоты в надземных частях растения и корнях демонстрирует потенциал этого растения в медицине 37 и косметической промышленности 38 . Из-за присутствия сиринговой кислоты и феруловой кислоты в листьях M. minima , это неиспользованное растение может быть отличным источником терапевтических и косметических соединений, которые могут предотвратить канцерогенез кожи 21,36,37,38 .Кроме того, лютеолин, кверцетин и синаповая кислота присутствуют во всех частях растения M. minima . Отсутствие феруловой кислоты в семенах M. minima характерно для черных бобов ( Vigna cylindrical ), тогда как она присутствует в других видах бобовых, таких как соя ( Glycine max ), арахис ( Arachis hypogaea ). ) и маш ( Vigna radiata ) 39 . Однако синапиновая кислота может оказывать различное воздействие на здоровье 20 .Эта фенольная кислота была идентифицирована в семенах M. minima (69,92 мкг / г СВ), и предыдущие исследования сообщили о ней в других семенах бобовых, таких как арахис, маш и соя 39 . Однако это соединение явно не способствует антиоксидантной активности в некоторых важных потребляемых растительных органах или продуктах питания, таких как мед и семена Lathyrus cicera 40,41 . Это наблюдение помещает M. minima в очень интересное положение для использования в качестве растения со специфической биологической активностью.Кроме того, лютеолин и кверцетин, присутствующие в семенах M. minima , также были идентифицированы в семенах L. cicera 32 .
Некоторые исследования заявили, что антиоксидантная активность таких органов растений может быть коррелирована с присутствием таких фенольных соединений, в основном потому, что высокое значение TPC и TFC указывает на высокую активность DPPH, ABTS и FRAP 42 . Наши результаты предполагают наличие значимой положительной корреляции между антиоксидантной способностью M.Minima листья и корни, а также их фенольное и флавоноидное содержание. Такие же результаты были получены для экстрактов орехов 16 , экстрактов чайных листьев 42 и ягодных экстрактов Hippophae rhamnoides 43 . Однако не было никакой корреляции между экстрактами семян M. minima и их высокой антиоксидантной способностью, как и для других экстрактов растений 44,45,46 . В некоторых исследованиях сообщается, что корреляция между фенольными соединениями и антиоксидантным потенциалом не является окончательной 24,26,27 .Эта возможность предполагает, что эта антиоксидантная активность создается неидентифицированным соединением. Следовательно, фитохимические соединения могут быть ключевыми из антиоксидантных элементов в M. minima семян 46 . Действительно, антиоксиданты играют важную роль в нейтрализации вредного воздействия окислительного стресса и предотвращении различных заболеваний, таких как ожирение, сердечно-сосудистые и нейродегенеративные заболевания 18,20,22 . Из-за присутствия этих соединений в различных M.Minima органов, это растение должно быть полезным и полезным для здоровья человека 5,19,26,36 . Фенольные профили в органах растения M. minima освещают эксплуатационный потенциал этого неиспользуемого растения 21,22,35,36,37,38 и отражают связь этого растения с его экосистемой 29,30,31,32 .
Влияние вариаций микросреды на фенольный состав в четырех органах растений
Доступность воды, температура, высота, УФ, почва и влажность являются важными факторами, влияющими на метаболизм и накопление вторичных метаболитов 4,11,33 .Таким образом, в качестве стратегии выживания, изменения окружающей среды в различных источниках происхождения приводят к изменению фенольных соединений растений 4,33 . Мы выделили двенадцать популяций, выбранных из различных климатических условий в Тунисе, с помощью PCA на основе фенольных профилей. В соответствии с другими исследованиями, наш результат предполагает, что изменение TPC и TFC среди популяций не связано с географическим расстоянием, но может быть связано с их естественной средой 11,47 .Поэтому важно отметить, что в разных органах растений могут быть различия в фенольной реакции на стресс окружающей среды 47,48 .
В корнях популяции из полузасушливых регионов с климатом BSK показали самое высокое содержание фенольных соединений, за исключением галловой кислоты. У населения из засушливых регионов с климатом BSK было самое высокое содержание галловой кислоты и самое низкое содержание всех других идентифицированных фенольных соединений. В этом случае фенольные соединения, по-видимому, увеличиваются в популяциях, адаптированных к полузасушливым регионам.Однако недавние исследования показали, что вторичные метаболиты (фенольные соединения) корневого экссудата Quercus ilex увеличиваются в стрессовых условиях 32 . Таким образом, корни M. minima , адаптированные к полузасушливым землям, находились в естественных стрессовых условиях по сравнению с корнями из засушливых регионов. Поскольку это подземный орган, доступность воды, состав почвы и среда обитания микроорганизмов могут влиять на метаболизм в корнях 11 . Кроме того, биотические стрессы, такие как микоризация, повышают уровень флавоноидов в корнях красного клевера 49 .Следовательно, M. minima — это вид бобовых, который может создавать симбиозную связь (клубень) между своим корнем и почвенными ризобиями 29,31,39 . Кроме того, цикл образования клубеньков включает производство растением флавоноидов, бетаинов и фенольных кислот в качестве сигнала микробному симбионту в корневых экссудатах 29,30,50 . Наши данные свидетельствуют о том, что содержание фенолов в корнях увеличивается у растений, адаптированных к более низким полузасушливым регионам, по сравнению с растениями из засушливых регионов.Следовательно, доступность воды в полузасушливых регионах может влиять на доступность кислорода, штамм ризобий и состав почвы 30,50 . Таким образом, корни, адаптированные к условиям засушливых земель, имели самое высокое содержание галловой кислоты в корнях, явление, которое может отражать взаимодействие между корнями и почвенными ризобиями. Следовательно, в условиях засухи корни M. minima могут образовывать больше симбиотических связей с помощью галловой кислоты 29 . Кроме того, исследование показало, что содержание фенольной кислоты в корнях значительно снизилось из-за низких температур 51 , что согласуется с нашими результатами, полученными в результате естественного процесса адаптации.Более того, Гаргалло-Гаррига и др. . пришли к выводу, что даже небольшие колебания в доступности воды могут иметь ощутимое влияние на состав корневых экссудатов 32 , что мы показали в нашем исследовании. Например, pop4, который был собран возле водозабора, накапливал больше фенольных соединений по сравнению с соединениями, адаптированными к той же микросреде (засушливый регион, низкая высота и климат BSH).
Что касается стебля, то у популяций, адаптированных к полузасушливому региону с климатом BSK, было самое высокое содержание идентифицированных соединений и самый низкий TPC.Напротив, популяции, расположенные в засушливых регионах с климатом BSK, имели самый высокий TPC и самое низкое идентифицированное содержание фенольных соединений. Следовательно, как Gossypium hirsutum и арахис, M. minima происходит из засушливых регионов, повышая их TPC как форму адаптации к засушливой среде 13,52 . Однако стебли M. minima , адаптированные к полузасушливым районам, имели более высокое содержание кверцетина и лютеолина по сравнению с таковыми из засушливой зоны. Этот процесс адаптации, по-видимому, является результатом реакции на повышение температуры, подобной той, что обнаружена у Lactuca sativa 11 .
Кроме того, фенольный состав листьев варьировался в зависимости от адаптации к окружающей среде, особенно с высотой. Например, некоторые исследования показали, что количество фенольных соединений, таких как антоцианы, увеличивается, когда растения подвергаются воздействию УФ-В излучения 53,54 . Действительно, ультрафиолетовое (УФ) излучение и атмосферное давление увеличиваются с высотой 55 . Следовательно, в качестве формы адаптации популяции, расположенные на более высокой высоте (более подверженные воздействию УФ-излучения), могут иметь больше фенольных соединений по сравнению с популяциями на более низких высотах 56 .Кроме того, согласно нашим предыдущим результатам, исходная популяция из полузасушливых сред может считаться естественным образом адаптированной к экологическому стрессу. Следовательно, при этих двух условиях (УФ-излучение и доступность воды) только M. minima особей, которые имеют самые высокие фенольные соединения в своих органах, могли выжить 11,53,54 . Множественные комбинированные стрессы окружающей среды могут по-разному влиять на фенольный состав открытых органов растений 11,54 .Таким образом, в ответ на комбинированные условия окружающей среды TPC листа различил изученные популяции M. minima в соответствии с их фенольными профилями. Популяции полузасушливых регионов показали самый высокий TPC по сравнению с популяциями засушливых регионов. Эти две контрастирующие группы занимают большую высоту с климатом BSK и образуют тунисские дорсальные горы.
Популяции не были хорошо различимы на основе данных по семенам; они полностью базировались в центре СПС.Следовательно, TPC не способствовал этой дифференциации. Обычно с помощью TFC можно отличить популяции засушливых земель от полузасушливых. Согласно литературным данным, флавоноиды присутствуют в большинстве семян растений в виде вторичных метаболитов 41,47 . Эти соединения защищают семена от патогенов и хищников и участвуют в созревании и покое семян 57 . Флавоноиды, безусловно, играют важную роль в прорастании семян; следовательно, мы обнаружили их во многих семенах, особенно в роде Medicago .Действительно, семена этого вида могут справиться с возможным заражением из-за их длительного цикла покоя до прорастания 57,58 . Флавоноиды также играют важную роль в прорастании семян 57 . Наши результаты показывают, что семена из полузасушливых регионов содержат самый высокий коэффициент трансформации. Это открытие может дать представление о скорости прорастания семян. Более того, MacGregor et al . продемонстрировал, что во время созревания семян низкие температуры вызывают увеличение экспрессии генов ферментов, участвующих в пути биосинтеза флавоноидов и процианидинов 59 .В результате растения M. minima , адаптированные к полузасушливым регионам, накапливают флавоноидные соединения в своих семенах больше, чем растения из засушливых регионов.
Интеграция всех органов данных в один PCA позволила нам понять стратегию адаптации M. minima к их различным естественным условиям. Наши данные свидетельствуют о том, что наибольшее содержание фенольных соединений наблюдается в группе I, в которую входят популяции из полузасушливых районов с климатом BSK и высотой более 550 м.Аналогичные результаты были получены для Potentilla fruticosa 56 . Действительно, эти популяции имеют самые высокие уровни всех соединений, участвующих в построении PCA. Согласно PCA, наиболее многочисленные популяции M. minima с точки зрения активных соединений проживают в климате BSK с большей высотой (группы I и II). В этом случае большая высота с климатом BSK может способствовать сохранению только растений M. minima с самым высоким содержанием TFC семян, TPC стебля и листьев кверцетина 11,53,56,59 .Дискриминация первой и второй группы подчеркнула разницу между двумя микросредами (засушливыми и полузасушливыми регионами) с одинаковым климатом (BSK). Популяции из засушливых регионов сформировали группу II, которая характеризовалась самыми низкими уровнями корневых TFC и TPC, стволовых TFC и некоторых идентифицированных соединений. Популяции с малых высот с климатом CSA или BSH сформировали группы III и IV соответственно. Соответственно, потепление (повышение температуры) снижает количество фенольных соединений и увеличивает количество летучих терпеноидов в растениях 11,12 , но эти изменения не согласуются с нашим наблюдением процесса адаптации M.Minima растений. Следовательно, фенольные профили корней могут быть основными параметрами, которые дифференцируют популяции из засушливых и полузасушливых земель, в то время как стебли могут быть параметрами, которые отличают климатические популяции BSK от климатических популяций CSA и BSH. С другой стороны, содержание фенольных соединений уменьшается с высотной адаптацией.
Как сообщалось во многих исследованиях, факторы окружающей среды влияют на вторичный метаболизм и антиоксидантную активность 12,56 . Наши результаты соответствуют этим предыдущим исследованиям.В частности, мы обнаружили, что растения, адаптированные к климату BSK, накапливают больше фенольных соединений по сравнению с растениями из BSH и CSA. Таким образом, фенольный состав каждого органа растения меняется в зависимости от адаптации к климату. Как и во многих других исследованиях, наши результаты подчеркивают важную неоднородность генетических ресурсов, адаптации к окружающей среде и географического положения в распределении фенольных соединений в растениях 46,47,60 . Следовательно, есть убедительные доказательства того, что различия в продукции и составе вторичных метаболитов, а также их потенциальной активности среди M.минимум популяций, может быть результатом процесса адаптации к окружающей среде 56,60,61 . Основываясь на наших результатах, содержание фенольных соединений было успешно использовано в качестве биохимических маркеров для распознавания природных популяций M. minima . Более того, распространение этих соединений в различных частях растений могло бы предоставить альтернативу для выбора и инженерных программ для повышения ценности этого неиспользуемого растения в интересующих областях.
Обзор роли диетических фенолов в лечении рака | Журнал питания
Russell W, Duthie G. Вторичные метаболиты растений и здоровье кишечника: пример фенольных кислот. Proc Nutr Soc. 2011; 70: 389–96.
CAS PubMed Статья Google ученый
Цао Р. Химия и биохимия пищевых полифенолов. Питательные вещества. 2010; 2: 1231–46.
CAS PubMed PubMed Central Статья Google ученый
Huang WY, Cai YZ, Zhang Y.Природные фенольные соединения из лекарственных и диетических растений: потенциальное использование для профилактики рака. Nutr Cancer. 2010; 62: 1–20.
PubMed Статья CAS Google ученый
Arts IC, Hollman PC. Полифенолы и риск заболеваний в эпидемиологических исследованиях. Am J Clin Nutr. 2005; 81: 317С – 25С.
CAS PubMed Google ученый
Ламберт Дж. Д., Хун Дж., Ян Дж., Ляо Дж., Ян К. С..Подавление канцерогенеза полифенолами: данные лабораторных исследований. Am J Clin Nutr. 2005; 81: 284С – 91С.
CAS PubMed Google ученый
Цин В., Галили Г. Биосинтетические пути шикимата и ароматических аминокислот у Arabidopsis thaliana. Книга арабидопсиса. 2010; 8: e0132.
PubMed PubMed Central Статья Google ученый
de Lourdes Reis Giada M. Пищевые фенольные соединения: основные классы, источники и их антиоксидантная способность. В: Хосе Антонио Моралес-Гонсалес, редакторы. Окислительный стресс и хронические дегенеративные заболевания — роль антиоксидантов. InTech; 2013. с. 87–112.
Ян К.С., Ландау Дж. М., Хуанг М. Т., Ньюмарк, HL. Подавление канцерогенеза диетическими полифенольными соединениями. Annu Rev Nutr. 2001; 21: 381–406.
CAS PubMed Статья Google ученый
Хан Н.С., Хади С.М. Структурные особенности дубильной кислоты важны для деградации ДНК в присутствии Cu (II). Мутагенез. 1998; 13: 271–4.
CAS PubMed Статья Google ученый
Де П, Балтас М., Бедос-Бельваль Ф. Производные коричной кислоты как противораковые агенты — обзор. Curr Med Chem. 2011; 18: 1672–703.
CAS PubMed Статья Google ученый
Cooper GM. Клетка: молекулярный подход. 2-е изд. Сандерленд: Sinauer Associates; 2000.
Google ученый
Пандей КБ, Ризви С.И. Полифенолы растений как диетические антиоксиданты для здоровья и болезней человека. Oxid Med Cell Longev. 2009; 2: 270–8.
PubMed PubMed Central Статья Google ученый
Кумар С., Пандей А.К. Химия и биологическая активность флавоноидов: обзор.ScientificWorldJournal. 2013; 2013: 162750.
PubMed PubMed Central Google ученый
Cheynier V. Полифенолы в пищевых продуктах сложнее, чем часто думают. Am J Clin Nutr. 2005; 81: 223С – 9С.
CAS PubMed Google ученый
Heim KE, Tagliaferro AR, Bobilya DJ. Флавоноидные антиоксиданты: химия, метаболизм и взаимосвязь между структурой и активностью.J Nutr Biochem. 2002; 13: 572–84.
CAS PubMed Статья Google ученый
Акк А. Реакция частей и возраста растений на распределение вторичных метаболитов на растениях в Кветте. Пак Дж. Бот. 2009. 41: 2129–35.
Google ученый
Dai J, Mumper RJ. Растительные фенолы: экстракция, анализ, их антиоксидантные и противораковые свойства. Молекулы.2010; 15: 7313–52.
CAS PubMed Статья Google ученый
Ververidis F, Trantas E, Douglas C, Vollmer G, Kretzschmar G, Panopoulos N. Биотехнология флавоноидов и других природных продуктов, полученных из фенилпропаноидов. Часть II: Реконструкция мультиферментных путей у растений и микробов. Biotechnol J. 2007; 2: 1235–49.
CAS PubMed Статья Google ученый
Спенсер Дж. П., Абд Эль Мохсен М. М., Минихейн А. М., Мазерс Дж. Биомаркеры приема диетических полифенолов: сильные стороны, ограничения и применение в исследованиях питания. Br J Nutr. 2008; 99: 12–22.
CAS PubMed Google ученый
Россетто М., Ланте А., Ванзани П., Спеттоли П., Скарпа М., Риго А. Красный цикорий как мощный поглотитель высокореактивных радикалов: исследование их фенольного состава, а также способности и эффективности улавливания пероксильных радикалов.J. Agric Food Chem. 2005; 53: 8169–75.
CAS PubMed Статья Google ученый
Кивиломполо М., Обурка В., Хиотилайнен Т. Сравнение методов ГХ-МС и ЖХ-МС для анализа антиоксидантных фенольных кислот в травах. Anal Bioanal Chem. 2007; 388: 881–7.
CAS PubMed Статья Google ученый
Перес-Хименес Дж., Невеу В., Вос Ф., Скальберт А.Определение 100 самых богатых пищевых источников полифенолов: приложение базы данных Phenol-Explorer. Eur J Clin Nutr. 2010; 64 Приложение 3: S112–120.
CAS PubMed Статья Google ученый
Вальдес-Моралес М., Эспиноза-Алонсо Л.Г., Эспиноза-Торрес Л.С., Дельгадо-Варгас Ф., Медина-Годой С. Содержание фенолов, а также антиоксидантная и антимутагенная активность в кожуре, семенах и побочных продуктах томатов. J. Agric Food Chem. 2014; 62: 5281–9.
CAS PubMed Статья Google ученый
Akyol H, Riciputi Y, Capanoglu E, Caboni MF, Verardo V. Фенольные соединения в картофеле и его побочных продуктах: обзор. Int J Mol Sci. 2016; 17: 835. DOI: 10.3390 / ijms17060835.
Лю Р.Дж., Чжу Х., Дин Л., Шакья С., Ян З.Л., Ченг Л. [Исследование фармакокинетики асперосапонина VI и его активного метаболита у крыс]. Чжунго Чжун Яо За Чжи. 2013; 38: 2378–83.
CAS PubMed Google ученый
Мартинес-Вальверде И., Периаго М.Дж., Рос Г. [Питательная ценность фенольных соединений в рационе]. Arch Latinoam Nutr. 2000; 50: 5–18.
CAS PubMed Google ученый
Крозье А., Джаганатх И.Б., Клиффорд Миннесота. Диетические фенолы: химический состав, биодоступность и влияние на здоровье. Nat Prod Rep. 2009; 26: 1001–43.
CAS PubMed Статья Google ученый
Давалли П., Рицци Ф., Капорали А., Пеллакани Д., Даволи С., Беттуцци С., Браузи М., Д’Арка Д. Противораковая активность полифенолов зеленого чая в предстательной железе. Oxid Med Cell Longev. 2012; 2012: 984219.
PubMed PubMed Central Статья CAS Google ученый
Кандасвами К., Ли LT, Ли П.П., Хван Дж.Дж., Ке ФК, Хуанг Ю.Т., Ли М.Т.Противоопухолевое действие флавоноидов. In Vivo. 2005; 19: 895–909.
PubMed Google ученый
Mursu J, Nurmi T, Tuomainen TP, Ruusunen A, Salonen JT, Voutilainen S. Потребление флавоноидов и атеросклероз сонных артерий: исследование факторов риска ишемической болезни сердца Куопио. Br J Nutr. 2007. 98: 814–8.
CAS PubMed Статья Google ученый
Letenneur L, Proust-Lima C, Le Gouge A, Dartigues JF, Barberger-Gateau P. Потребление флавоноидов и снижение когнитивных функций за 10-летний период. Am J Epidemiol. 2007; 165: 1364–71.
CAS PubMed Статья Google ученый
Марин Л., Мигелес Э.М., Виллар С.Дж., Ломбо Ф. Биодоступность пищевых полифенолов и метаболизм кишечной микробиоты: антимикробные свойства. Biomed Res Int. 2015; 2015:
5.PubMed PubMed Central Статья CAS Google ученый
Саха П., Йео Б.С., Сингх Р., Чандрасекар Б., Вемула П.К., Харибабу Б., Виджай-Кумар М., Джала В.Р. Микробиота кишечника превращает диетическую эллаговую кислоту в биоактивный фито-цевтический уролитин А, подавляя пероксидазу гема. PLoS One. 2016; 11: e0156811.
PubMed PubMed Central Статья CAS Google ученый
Вьяс У, Ранганатан Н. Пробиотики, пребиотики и синбиотики: кишечник и не только. Гастроэнтерол Рес Прак. 2012; 2012: 872716.
PubMed PubMed Central Статья Google ученый
Ghasemzadeh A, Jaafar HZ. Профилирование фенольных соединений и их антиоксидантной и противораковой активности в экстрактах пандана (Pandanus amaryllifolius Roxb.) Из разных мест Малайзии. BMC Complement Altern Med. 2013; 13: 341.
PubMed PubMed Central Статья CAS Google ученый
de Oliveira CB, Comunello LN, Maciel ES, Giubel SR, Bruno AN, Chiela EC, Lenz G, Gnoatto SC, Buffon A, Gosmann G. Ингибирующие эффекты фенольных и терпеноидных соединений из Baccharis trimera в клетках Siha: различия в их активность и механизм действия. Молекулы. 2013; 18: 11022–32.
PubMed Статья CAS Google ученый
Senawong T, Khaopha S, Misunaa S, Komaikula J, Senawonga G, Wongphakhama P, Yunchalard S.Состав фенольной кислоты и противораковая активность коммерчески доступных продуктов ферментации Houttuynia cordata в отношении линий раковых клеток человека. Sci Asia. 2014; 40: 420–7.
CAS Статья Google ученый
Chen HM, Wu YC, Chia YC, Chang FR, Hsu HK, Hsieh YC, Chen CC, Yuan SS. Галловая кислота, главный компонент экстрактов листьев Toona sinensis, содержит ROS-опосредованную противораковую активность в клетках рака простаты человека.Cancer Lett. 2009; 286: 161–71.
CAS PubMed Статья Google ученый
Курата Р., Адачи М., Ямакава О., Йошимото М. Подавление роста раковых клеток человека полифенолами из листьев сладкого картофеля (Ipomoea batatas L.). J. Agric Food Chem. 2007; 55: 185–90.
CAS PubMed Статья Google ученый
Ли Й.Дж., Ляо PH, Чен В.К., Ян ЦЮ.Предпочтительная цитотоксичность аналогов фенэтилового эфира кофейной кислоты на раковые клетки полости рта. Cancer Lett. 2000; 153: 51–6.
CAS PubMed Статья Google ученый
Chen M, Meng H, Zhao Y, Chen F, Yu S. Антиоксидантная и противораковая активность in vitro фенольных соединений, выделенных из патоки сахарной свеклы. BMC Complement Altern Med. 2015; 15: 313.
PubMed PubMed Central Статья CAS Google ученый
Shahrzad S, Aoyagi K, Winter A, Koyama A, Bitsch I. Фармакокинетика галловой кислоты и ее относительная биодоступность из чая у здоровых людей. J Nutr. 2001; 131: 1207–10.
CAS PubMed Google ученый
Хо ХХ, Чанг С.С., Хо В.С., Ляо С.И., Лин В.Л., Ван СиДжей. Галловая кислота подавляет метастазирование и инвазивный рост клеток рака желудка за счет увеличения экспрессии RhoB, подавления сигналов AKT / малых GTPase и ингибирования активности NF-kappaB.Toxicol Appl Pharmacol. 2013; 266: 76–85.
CAS PubMed Статья Google ученый
Линь Х. Х., Чен Дж. Х., Чжоу Ф. П., Ван Си Джей. Протокатеховая кислота подавляет метастазирование раковых клеток, включая подавление пути Ras / Akt / NF-kappaB и продукцию MMP-2, направляя активацию RhoB. Br J Pharmacol. 2011; 162: 237–54.
CAS PubMed PubMed Central Статья Google ученый
Kassi E, Chinou I, Spilioti E, Tsiapara A, Graikou K, Karabournioti S, Manoussakis M, Moutsatsou P. Монотерпен, уникальный компонент меда тимьяна, индуцирует апоптоз в клетках рака простаты посредством ингибирования активности NF-kappaB и IL- 6 секреция. Фитомедицина. 2014; 21: 1483–9.
CAS PubMed Статья Google ученый
Зайдель С., Шнекенбургер М., Дикато М., Дидерих М. Антипролиферативная и проапоптотическая активность ингибиторов гистондеацетилаз на основе 4-гидроксибензойной кислоты.Cancer Lett. 2014; 343: 134–46.
CAS PubMed Статья Google ученый
Инь М.К., Линь С.К., Ву Х.С., Цао С.М., Сюй СК. Апоптотические эффекты протокатеховой кислоты в клетках рака груди, легких, печени, шейки матки и предстательной железы человека: потенциальные механизмы действия. J. Agric Food Chem. 2009; 57: 6468–73.
CAS PubMed Статья Google ученый
Ван Л.К., Чу К.Х., Лян Ю.С., Лин Ю.Л., Чианг Б.Л.Фенэтиловый эфир кофейной кислоты ингибирует сигнальные пути ядерного фактора-каппаB и протеинкиназы B и индуцирует экспрессию каспазы-3 в первичных CD4 + Т-клетках человека. Clin Exp Immunol. 2010; 160: 223–32.
CAS PubMed PubMed Central Статья Google ученый
Fukuda M, Kobayashi K, Hirono Y, Miyagawa M, Ishida T, Ejiogu EC, Sawai M, Pinkerton KE, Takeuchi M. Мед джунглей усиливает иммунную функцию и противоопухолевую активность.Evid Based Complement Alternat Med. 2011; 2011:
3.
PubMed Статья Google ученый
Samarghandian S, Afshari JT, Davoodi S. Honey индуцирует апоптоз в почечно-клеточной карциноме. Pharmacogn Mag. 2011; 7: 46–52.
PubMed PubMed Central Статья Google ученый
Ли YJ, Kuo HC, Chu CY, Wang CJ, Lin WC, Tseng TH. Участие белка-супрессора опухолей p53 и p38 MAPK в апоптозе клеток глиомы C6, вызванном фенэтиловым эфиром кофейной кислоты.Biochem Pharmacol. 2003; 66: 2281–9.
CAS PubMed Статья Google ученый
Jaganathan SK, Supriyanto E, Mandal M. События, связанные с апоптотическим эффектом p-кумаровой кислоты в раковых клетках толстой кишки HCT-15. Мир Дж. Гастроэнтерол. 2013; 19: 7726–34.
CAS PubMed PubMed Central Статья Google ученый
Nagaoka T, Banskota AH, Tezuka Y, Saiki I, Kadota S.Селективная антипролиферативная активность аналогов фенэтилового эфира кофейной кислоты на линии клеток карциномы 26-L5 толстой кишки мышей с высокой метастатической печенью. Bioorg Med Chem. 2002; 10: 3351–9.
CAS PubMed Статья Google ученый
Hanahan D, Weinberg RA. Признаки рака: следующее поколение. Клетка. 2011; 144: 646–74.
CAS PubMed Статья Google ученый
Шапиро Г.И., Харпер Дж.В. Мишени противораковых препаратов: контроль клеточного цикла и контрольных точек. J Clin Invest. 1999; 104: 1645–53.
CAS PubMed PubMed Central Статья Google ученый
Niero EL, Machado-Santelli GM. Коричная кислота вызывает апоптотическую гибель клеток и нарушение цитоскелета в клетках меланомы человека. J Exp Clin Cancer Res. 2013; 32: 31.
PubMed PubMed Central Статья CAS Google ученый
Guo H, Li M, Chen P, Blake DJ, Kong X, Hao X, Niu R, Zhang N. 4-метил-3-нитробензойная кислота, ингибитор миграции, предотвращает метастазирование рака груди у мышей SCID. Cancer Lett. 2011; 305: 69–75.
CAS PubMed Статья Google ученый
Murad LD, Soares Nda C, Brand C, Monteiro MC, Teodoro AJ. Влияние кофеиновой и 5-кофеилхиновой кислот на жизнеспособность клеток и клеточное поглощение клетками аденокарциномы толстой кишки человека.Nutr Cancer. 2015; 67: 532–42.
CAS PubMed Статья Google ученый
Раджендра Прасад Н., Картикеян А., Картикеян С., Редди Б.В. Ингибирующее действие кофейной кислоты на пролиферацию раковых клеток по окислительному механизму в линии клеток фибросаркомы человека HT-1080. Mol Cell Biochem. 2011; 349: 11–9.
CAS PubMed Статья Google ученый
Fahrioglu U, Dodurga Y, Elmas L, Secme M. Феруловая кислота снижает жизнеспособность клеток и образование колоний, ингибируя миграцию клеток рака поджелудочной железы человека MIA PaCa-2 in vitro. Ген. 2016; 576: 476–82.
CAS PubMed Статья Google ученый
Чжао Б., Ху М. Галловая кислота снижает жизнеспособность, пролиферацию, инвазию и ангиогенез в клетках рака шейки матки человека. Oncol Lett. 2013; 6: 1749–55.
CAS PubMed PubMed Central Google ученый
Сурани З. Влияние галловой кислоты на линию клеток Jurkat. J HerbMed Pharmacol. 2015; 4: 129–32.
Google ученый
Pontiki E, Hadjipavlou-Litina D, Litinas K, Geromichalos G. Новые производные коричной кислоты в качестве антиоксидантных и противораковых агентов: исследования дизайна, синтеза и моделирования. Молекулы. 2014; 19: 9655–74.
PubMed Статья CAS Google ученый
Элмор С. Апоптоз: обзор запрограммированной гибели клеток. Toxicol Pathol. 2007. 35: 495–516.
CAS PubMed PubMed Central Статья Google ученый
Pirzad G, Jafari M, Tavana S, Sadrayee H, Ghavami S, Shajiei A, Ghanei M. Роль сигнального пути Fas-FasL в индукции апоптоза у пациентов с хроническим бронхиолитом, вызванным серным ипритом. J Toxicol. 2010; 2010: 373612.
PubMed Статья CAS Google ученый
Ригер AM, Нельсон KL, Коновальчук JD, Barreda DR. Модифицированный анализ апоптоза аннексина V / пропидия иодида для точной оценки гибели клеток. Журнал визуализированных экспериментов: JoVE. 2011; 50; 2597. DOI: 10,3791 / 2597.
Annamalai P, Thayman M, Rajan S, Raman LS, Ramasubbu S, Perumal P. Экстракт этилацетата из морской губки Hyattella cribriformis проявляет мощную противораковую активность, способствуя полимеризации тубулина, что свидетельствует об остановке митоза и индукции апоптоза.Pharmacogn Mag. 2015; 11: 345–55.
PubMed PubMed Central Статья Google ученый
Clark AG, Vignjevic DM. Способы инвазии раковых клеток и роль микросреды. Curr Opin Cell Biol. 2015; 36: 13–22.
CAS PubMed Статья Google ученый
Zhang X, Lin D, Jiang R, Li H, Wan J, Li H. Феруловая кислота проявляет противоопухолевую активность и подавляет метастазирование в клетках рака груди, регулируя переход эпителия в мезенхиму.Онкол Реп. 2016; 36: 271–8.
PubMed Google ученый
Fraser SP, Hemsley F, Djamgoz MB. Фенэтиловый эфир кофейной кислоты: ингибирование поведения метастатических клеток через потенциал-управляемые натриевые каналы при раке груди человека in vitro. Int J Biochem Cell Biol. 2016; 71: 111–8.
CAS PubMed Статья Google ученый
Андрикопулос П., Фрейзер С.П., Паттерсон Л., Ахмад З., Бурку Х., Оттавиани Д., Дисс Дж. К., вставка С, Экклс С.А., Джамгоз МБ.Ангиогенные функции потенциал-управляемых каналов Na + в эндотелиальных клетках человека: модуляция передачи сигналов фактора роста эндотелия сосудов (VEGF). J Biol Chem. 2011; 286: 16846–60.
CAS PubMed PubMed Central Статья Google ученый
Peng CY, Yang HW, Chu YH, Chang YC, Hsieh MJ, Chou MY, Yeh KT, Lin YM, Yang SF, Lin CW. Фенэтиловый эфир кофейной кислоты подавляет метастазирование раковых клеток полости рта, регулируя матриксную металлопротеиназу-2 и путь митоген-активируемой протеинкиназы.Evid Based Complement Alternat Med. 2012; 2012: 732578.
PubMed PubMed Central Google ученый
Хабаузит В., Моран С. Доказательства защитного эффекта продуктов, содержащих полифенолы, на здоровье сердечно-сосудистой системы: обновленная информация для врачей. Ther Adv Chronic Dis. 2012; 3: 87–106.
CAS PubMed PubMed Central Статья Google ученый
Hirose M, Fukushima S, Shirai T, Hasegawa R, Kato T, Tanaka H, Asakawa E, Ito N. Канцерогенность желудка кофеиновой кислоты, сезамола и катехола у крыс и мышей. Jpn J Cancer Res. 1990; 81: 207–12.
CAS PubMed Статья Google ученый
Kakkar S, Bais S. Обзор протокатеховой кислоты и ее фармакологического потенциала. ISRN Pharmacol. 2014; 2014: 952943.
PubMed PubMed Central Статья Google ученый
Нихо Н., Шибутани М., Тамура Т., Тойода К., Унеяма С., Такахаши Н., Хиросе М. Исследование субхронической токсичности галловой кислоты при пероральном введении крысам F344. Food Chem Toxicol. 2001; 39: 1063–70.
CAS PubMed Статья Google ученый
Rajalakshmi K, Devaraj H, Niranjali Devaraj S. Оценка уровня отсутствия наблюдаемых побочных эффектов (NOAEL) галловой кислоты у мышей. Food Chem Toxicol. 2001; 39: 919–22.
CAS PubMed Статья Google ученый
Pei K, Ou J, Huang J, Ou S. p-Кумаровая кислота и ее конъюгаты: пищевые источники, фармакокинетические свойства и биологическая активность. J Sci Food Agric. 2016; 96: 2952–62.
CAS PubMed Статья Google ученый
Тернер П.В., Брабб Т., Пеков С., Васбиндер М.А. Введение веществ лабораторным животным: пути введения и факторы, которые следует учитывать. J Am Assoc Lab Anim Sci. 2011; 50: 600–13.
CAS PubMed PubMed Central Google ученый
Konishi Y, Hitomi Y, Yoshioka E. Поглощение в кишечнике р-кумариновой и галловой кислот у крыс после перорального приема. J. Agric Food Chem. 2004. 52: 2527–32.
CAS PubMed Статья Google ученый
Kern SM, Bennett RN, Mellon FA, Kroon PA, Garcia-Conesa MT. Поглощение гидроксициннаматов у людей после употребления большого количества отрубей из зерновых. J. Agric Food Chem. 2003. 51: 6050–5.
CAS PubMed Статья Google ученый
Konishi Y, Kobayashi S, Shimizu M. Трансэпителиальный транспорт п-кумаровой кислоты и галловой кислоты в монослоях клеток Caco-2. Biosci Biotechnol Biochem. 2003. 67: 2317–24.
CAS PubMed Статья Google ученый
Adam A, Crespy V, Levrat-Verny MA, Leenhardt F, Leuillet M, Demigne C., Remesy C. Биодоступность феруловой кислоты регулируется в первую очередь пищевой матрицей, а не ее метаболизмом в кишечнике и печени. крысы.J Nutr. 2002; 132: 1962–8.
CAS PubMed Google ученый
D’Archivio M, Filesi C, Di Benedetto R, Gargiulo R, Giovannini C, Masella R. Полифенолы, пищевые источники и биодоступность. Энн Ист Супер Санита. 2007. 43: 348–61.
PubMed Google ученый
Chiang EP, Tsai SY, Kuo YH, Pai MH, Chiu HL, Rodriguez RL, Tang FY. Производные кофейной кислоты подавляют рост рака толстой кишки: вовлечение сигнальных путей PI3-K / Akt и AMPK.PLoS One. 2014; 9: e99631.
PubMed PubMed Central Статья CAS Google ученый
Чанг Т.В., Мун С.К., Чанг Й.С., Ко Дж.Х., Ли Ю.С., Чо Джи, Ким Ш., Ким Дж.Г., Ким Ч. Новое и терапевтическое действие кофейной кислоты и фенилового эфира кофейной кислоты на клетки гепатокарциномы: полная регрессия роста гепатомы и метастазирования по двойному механизму. FASEB J. 2004; 18: 1670–81.
CAS PubMed Статья Google ученый
Онори П., Деморроу С., Гаудио Э., Франчитто А., Мансинелли Р., Вентер Дж., Коприва С., Уэно И., Альваро Д., Сэвидж Дж. И др. Фенетиловый эфир кофейной кислоты снижает рост холангиокарциномы за счет ингибирования NF-kappaB и индукции апоптоза. Int J Cancer. 2009; 125: 565–76.
CAS PubMed PubMed Central Статья Google ученый
Ян GW, Jiang JS, Lu WQ. Феруловая кислота проявляет антиангиогенную и противоопухолевую активность, воздействуя на ангиогенез, опосредованный рецептором 1 фактора роста фибробластов.Int J Mol Sci. 2015; 16: 24011–31.
CAS PubMed PubMed Central Статья Google ученый
Лян Ч.З., Чжан Х, Ли Х, Тао YQ, Тао LJ, Ян З.Р., Чжоу XP, Ши З.Л., Тао Х.М. Галловая кислота индуцирует апоптоз клеток остеосаркомы человека in vitro и in vivo посредством регуляции путей митоген-активируемых протеинкиназ. Биотерма для рака Радиофарм. 2012; 27: 701–10.
CAS PubMed PubMed Central Статья Google ученый
Райна К., Раджаманикам С., Дип Дж., Сингх М., Агарвал Р., Агарвал С. Химиопрофилактические эффекты перорального кормления галловой кислотой на рост и прогрессирование опухоли у мышей TRAMP. Mol Cancer Ther. 2008; 7: 1258–67.
CAS PubMed Статья Google ученый
Zhu B, Shang B, Li Y, Zhen Y. Ингибирование гистондеацетилаз транс-коричной кислотой и ее противоопухолевый эффект против ксенотрансплантатов рака толстой кишки у бестимусных мышей. Mol Med Rep.2016; 13: 4159–66.
CAS PubMed PubMed Central Google ученый
Мерфи MP. Как митохондрии производят активные формы кислорода. Биохим Дж. 2009; 417: 1–13.
CAS PubMed Статья Google ученый
Ray PD, Huang BW, Tsuji Y. Гомеостаз активных форм кислорода (ROS) и окислительно-восстановительная регуляция в клеточной передаче сигналов. Сотовый сигнал. 2012; 24: 981–90.
CAS PubMed PubMed Central Статья Google ученый
Рахман К. Исследования свободных радикалов, антиоксидантов и кофакторов. Clin Interv Aging. 2007; 2: 219–36.
CAS PubMed PubMed Central Google ученый
Gill SS, Tuteja N. Активные формы кислорода и антиоксидантные механизмы в устойчивости сельскохозяйственных культур к абиотическому стрессу.Plant Physiol Biochem. 2010; 48: 909–30.
CAS PubMed Статья Google ученый
Nakabeppu Y, Tsuchimoto D, Ichinoe A, Ohno M, Ide Y, Hirano S, Yoshimura D, Tominaga Y, Furuichi M, Sakumi K. Биологическое значение защитных механизмов против окислительного повреждения нуклеиновых кислот, вызванных активные формы кислорода: от митохондрий к ядрам. Ann N Y Acad Sci. 2004; 1011: 101–11.
CAS PubMed Статья Google ученый
Бенедетти С., Нуволи Б., Каталани С., Галати Р. Активные формы кислорода — палка о двух концах мезотелиомы. Oncotarget. 2015; 6: 16848–65.
PubMed PubMed Central Статья Google ученый
Никитаки З., Хелльвег CE, Георгакилас АГ, Раванат Дж.Л. Биомаркеры стресс-индуцированного повреждения ДНК: применение и ограничения. Front Chem. 2015; 3:35.
PubMed PubMed Central Статья CAS Google ученый
Джаганатан SK. Подавление роста кофеиновой кислотой, одним из фенольных компонентов меда, в раковых клетках толстой кишки HCT 15. ScientificWorldJournal. 2012; 2012: 372345.
PubMed PubMed Central Статья CAS Google ученый
Lodish HBA, Zipursky SL. Молекулярная клеточная биология. 4-е изд. 2000.
Google ученый
Дэвис Х., Бигнелл Г.Р., Кокс С., Стивенс П., Эдкинс С., Клегг С., Тиг Дж., Воффендин Х., Гарнетт М.Дж., Боттомли В. и др.Мутации гена BRAF при раке человека. Природа. 2002; 417: 949–54.
CAS PubMed Статья Google ученый
Leicht DT, Balan V, Kaplun A, Singh-Gupta V, Kaplun L, Dobson M, Tzivion G. Киназы Raf: функция, регуляция и роль в раке человека. Biochim Biophys Acta. 1773; 2007: 1196–212.
Google ученый
Wajapeyee N, Serra RW, Zhu X, Mahalingam M, Green MR.Онкогенный BRAF вызывает старение и апоптоз посредством путей, опосредованных секретируемым белком IGFBP7. Клетка. 2008; 132: 363–74.
CAS PubMed PubMed Central Статья Google ученый
Cheung M, Sharma A, Madhunapantula SV, Robertson GP. Akt3 и мутант V600E B-Raf взаимодействуют, способствуя раннему развитию меланомы. Cancer Res. 2008. 68: 3429–39.
CAS PubMed PubMed Central Статья Google ученый
Aquilato A, Lopez V, Doonan B, Hsieh T-C, Pinto JT, Wu E, Wu JM. Мутация RAF при меланоме и диетические полифенолы как дополнительная стратегия лечения. Полифенолы Hum Health Dis. 2014; 102: 1353–65.
Артикул CAS Google ученый
Lamoral-Theys D, Pottier L, Dufrasne F, Neve J, Dubois J, Kornienko A, Kiss R, Ingrassia L. Природные полифенолы, которые проявляют противораковые свойства за счет ингибирования киназной активности.Curr Med Chem. 2010; 17: 812–25.
CAS PubMed Статья Google ученый
Кан Н.Дж., Ли К.В., Ким Б.Х., Бод А.М., Ли Х.Дж., Хео Ю.С., Бордман Л., Лимбург П., Ли Х.Дж., Донг З. Фенольные фитохимические вещества кофе подавляют метастазы рака толстой кишки, воздействуя на МЕК и ТОПК. Канцерогенез. 2011; 32: 921–8.
CAS PubMed PubMed Central Статья Google ученый
Ким С.Р., Юнг Ю.Р., Ким Д.Х., Ан Х.Дж., Ким М.К., Ким Н.Д., Чанг Х.Й. Кофеиновая кислота регулирует LPS-индуцированную активацию NF-kappaB через сигнальные пути NIK / IKK и c-Src / ERK в эндотелиальных клетках. Arch Pharm Res. 2014; 37: 539–47.
CAS PubMed Статья Google ученый
Tsao SM, Hsia TC, Yin MC. Протокатеховая кислота подавляет клетки рака легких, модулируя пути FAK, MAPK и NF-kappaB. Nutr Cancer. 2014; 66: 1331–41.
CAS PubMed Статья Google ученый
Pramanik KC, Kudugunti SK, Fofaria NM, Moridani MY, Srivastava SK. Фенэтиловый эфир кофейной кислоты подавляет рост опухоли меланомы, ингибируя путь PI3K / AKT / XIAP. Канцерогенез. 2013; 34: 2061–70.
CAS PubMed PubMed Central Статья Google ученый
Lin HP, Jiang SS, Chuu CP.Фенетиловый эфир кофейной кислоты вызывает индукцию p21, снижение передачи сигналов Akt и ингибирование роста в клетках рака предстательной железы человека PC-3. PLoS One. 2012; 7: e31286.
CAS PubMed PubMed Central Статья Google ученый
Цай СМ, Йен ГК, Сунь ФМ, Ян СФ, Вэн СиДжей. Оценка антиинвазионного потенциала и механизма выбора производных коричной кислоты на клетках аденокарциномы легких человека. Mol Pharm. 2013; 10: 1890–900.
CAS PubMed Статья Google ученый
Guo XE, Ngo B, Modrek AS, Lee WH. Нацеленность на сети супрессоров опухолей для лечения рака. Curr Drug Targets. 2014; 15: 2–16.
CAS PubMed PubMed Central Статья Google ученый
van Heemst D, Mooijaart SP, Beekman M, Schreuder J, de Craen AJ, Brandt BW, Slagboom PE, Westendorp RG, Long Life study g.Вариация гена TP53 человека влияет на выживаемость в пожилом возрасте и смертность от рака. Exp Gerontol. 2005; 40: 11–5.
PubMed Статья CAS Google ученый
Lin HP, Lin CY, Huo C, Hsiao PH, Su LC, Jiang SS, Chan TM, Chang CH, Chen LT, Kung HJ, et al. Фенетиловый эфир кофейной кислоты индуцировал остановку клеточного цикла и ингибирование роста андроген-независимых клеток рака простаты посредством регуляции Skp2, p53, p21Cip1 и p27Kip1.Oncotarget. 2015; 6: 6684–707.
PubMed PubMed Central Статья Google ученый
Чанг У.С., Се Ч., Сяо М.В., Лин У.С., Хунг Ю.С., Й.С. Кофеиновая кислота индуцирует апоптоз в клетках рака шейки матки человека через митохондриальный путь. Тайвань J Obstet Gynecol. 2010; 49: 419–24.
PubMed Статья Google ученый
Hung MW, Shiao MS, Tsai LC, Chang GG, Chang TC.Апоптотический эффект фенэтилового эфира кофейной кислоты и его сложных эфиров и амидных аналогов в клетках рака шейки матки человека ME180. Anticancer Res. 2003; 23: 4773–80.
CAS PubMed Google ученый
Lin X-F. Антиканцерогенное действие феруловой кислоты на облученные ультрафиолетом B клетки HaCaT кератиноцитов человека. J Med Plants Res. 2010; 4: 1686–94.
CAS Google ученый
Shon W-K. Индукция апоптоза протокатеховой кислотой гибискуса в клетках лейомиомы матки человека. Корейский J Gynecol Oncol. 2008; 19: 48–56.
Артикул Google ученый
Dinarello CA. Провоспалительные цитокины. Грудь. 2000; 118: 503–8.
CAS PubMed Статья Google ученый
Замаррон Б.Ф., Чен В. Двойная роль иммунных клеток и их факторов в развитии и прогрессировании рака.Int J Biol Sci. 2011; 7: 651–8.
CAS PubMed PubMed Central Статья Google ученый
Дранофф Г. Цитокины в патогенезе рака и терапии рака. Нат Рев Рак. 2004; 4: 11–22.
CAS PubMed Статья Google ученый
Sarosiek KA, Malumbres R, Nechushtan H, Gentles AJ, Avisar E, Lossos IS. Новый сигнальный путь IL-21 активирует c-Myc и индуцирует апоптоз диффузных больших B-клеточных лимфом.Кровь. 2010; 115: 570–80.
CAS PubMed PubMed Central Статья Google ученый
Nilsson JA, Cleveland JL. Пути Myc, провоцирующие самоубийство клеток и рак. Онкоген. 2003. 22: 9007–21.
CAS PubMed Статья Google ученый
Xiang D, Wang D, He Y, Xie J, Zhong Z, Li Z, Xie J. Фенетиловый эфир кофейной кислоты вызывает остановку роста и апоптоз раковых клеток толстой кишки через бета-катенин / Т-клеточный фактор сигнализация.Противораковые препараты. 2006. 17: 753–62.
CAS PubMed Статья Google ученый
Zhu JY, Pang ZJ, Yu YH. Регуляция инвазии трофобластов: роль матриксных металлопротеиназ. Преподобный Obstet Gynecol. 2012; 5: e137–143.
PubMed PubMed Central Google ученый
Кессенброк К., Плакс В., Верб З. Матричные металлопротеиназы: регуляторы микросреды опухоли.Клетка. 2010. 141: 52–67.
CAS PubMed PubMed Central Статья Google ученый
Киселова З. Токсикологические аспекты использования фенольных соединений в профилактике заболеваний. Междисциплинарный токсикол. 2011; 4: 173–83.
CAS PubMed PubMed Central Статья Google ученый
Vermerris W, Nicholson R. Фенольные соединения и их влияние на здоровье человека.В: Вермеррис В., Николсон Р., редакторы. Биохимия фенольных соединений. Springer Science; 2006. с. 235–255.
Миллер Д., Уилз Б. Б., Бересфорд Н., Самптер Дж. П. Эстрогенная активность фенольных добавок определяется биотестом на дрожжах in vitro. Перспектива здоровья окружающей среды. 2001; 109: 133–8.
CAS PubMed PubMed Central Статья Google ученый
Sporn MB, Liby KT. NRF2 и рак: хорошее, плохое и важность контекста.Нат Рев Рак. 2012; 12: 564–71.
CAS PubMed Статья Google ученый
Pandurangan AK, Mohebali N, Norhaizan ME, Looi CY. Галловая кислота ослабляет экспериментальный колит, вызванный декстрансульфатом натрия, у мышей BALB / c. Drug Des Devel Ther. 2015; 9: 3923–34.
PubMed PubMed Central Статья Google ученый
Kim H, Kim W, Yum S, Hong S, Oh JE, Lee JW, Kwak MK, Park EJ, Na DH, Jung Y.Активация фенэтилового эфира кофейной кислоты пути Nrf2 усиливается в окислительном состоянии: структурный анализ и потенциал в качестве патологически направленного терапевтического агента при лечении воспаления толстой кишки. Free Radic Biol Med. 2013; 65: 552–62.
CAS PubMed Статья Google ученый
Ma ZC, Hong Q, Wang YG, Liang QD, Tan HL, Xiao CR, Tang XL, Shao S, Zhou SS, Gao Y. Феруловая кислота индуцирует гемоксигеназу-1 посредством активации ERK и Nrf2.Drug Discov Ther. 2011; 5: 299–305.
CAS PubMed Статья Google ученый
Pacheco-Palencia LA, Mertens-Talcott S, Talcott ST. Химический состав, антиоксидантные свойства и термическая стабильность обогащенного фитохимическими веществами масла из асаи (Euterpe oleracea Mart.). J. Agric Food Chem. 2008. 56: 4631–6.
CAS PubMed Статья Google ученый
Фогт Т. Биосинтез фенилпропаноидов. Завод Мол. 2010; 3: 2–20.
CAS PubMed Статья Google ученый
Budavari S. Индекс Merck: энциклопедия химических веществ, лекарств и биологических препаратов. 12-е изд. 1996.
Google ученый
Hernanz D, Nunez V, Sancho AI, Faulds CB, Williamson G, Bartolome B, Gomez-Cordoves C. Гидроксикоричные кислоты и дегидродимеры феруловой кислоты в ячмене и переработанном ячмене.J. Agric Food Chem. 2001. 49 (10): 4884–8.
CAS PubMed Статья Google ученый
Mao WSM, Berenbaum MR. Компоненты меда активируют гены детоксикации и иммунитета у западной медоносной пчелы Apis mellifera. Proc Natl Acad Sci U S. A. 2013; 110: 8842–6.
CAS PubMed PubMed Central Статья Google ученый
Li CY, Lee EJ, Wu TS.Принципы антитирозиназы и составляющие лепестков Crocus sativus. J Nat Prod. 2004. 67: 437–40.
CAS PubMed Статья Google ученый
Khadem S, Marles RJ. Моноциклические фенольные кислоты; гидрокси- и полигидроксибензойные кислоты: возникновение и недавние исследования биоактивности. Молекулы. 2010; 15: 7985–8005.
CAS PubMed Статья Google ученый
Quinde-Axtell Z, Baik BK. Фенольные соединения зерна ячменя и их влияние на изменение цвета пищевых продуктов. J. Agric Food Chem. 2006; 54: 9978–84.
CAS PubMed Статья Google ученый
Онакпоя И., Терри Р., Эрнст Э. Использование экстракта зеленого кофе в качестве добавки для похудания: систематический обзор и метаанализ рандомизированных клинических испытаний. Гастроэнтерол Рес Прак. 2011; 2011: 382852.
PubMed Статья Google ученый
Паницци Л.С., Луиза М. Конституция цинарина, активного начала артишока. Природа. 1954; 1954 (174): 1062–3.
Артикул Google ученый
Sanderson JT, Clabault H, Patton C, Lassalle-Claux G, Jean-Francois J, Pare AF, Hebert MJ, Surette ME, Touaibia M. Антипролиферативные, антиандрогенные и цитотоксические эффекты новых производных кофейной кислоты в LNCaP клетки андроген-зависимого рака простаты человека. Bioorg Med Chem.2013; 21: 7182–93.
CAS PubMed Статья Google ученый
Rzepecka-Stojko A, Kabala-Dzik A, Mozdzierz A, Kubina R, Wojtyczka RD, Stojko R, Dziedzic A, Jastrzebska-Stojko Z, Jurzak M, Buszman E, Acid ester J. Caffeic этанольный экстракт прополиса вызывает дополнительный цитотоксический эффект на трижды отрицательные линии клеток рака молочной железы. Молекулы. 2015; 20: 9242–62.
CAS PubMed Статья Google ученый
Шайласри С., Венкатарамана М., Ниранджана С.Р., Пракаш Х.С. Цитотоксический эффект п-кумаровой кислоты на нейробластому, клетку N2a посредством генерации активных форм кислорода, приводящих к дисфункции митохондрий, вызывая апоптоз и аутофагию. Mol Neurobiol. 2015; 51: 119–30.
CAS PubMed Статья Google ученый
Chang MY, Shen YL. Линалоол проявляет цитотоксическое действие за счет активации противоопухолевого иммунитета. Молекулы.2014; 19: 6694–706.
PubMed Статья CAS Google ученый
Eroglu C, Secme M, Bagci G, Dodurga Y. Оценка противоракового механизма феруловой кислоты через клеточный цикл и пути апоптоза в клеточных линиях рака простаты человека. Tumor Biol. 2015; 36: 9437–46.
CAS PubMed Статья Google ученый
Деви Ю.П., Ума А., Нарасу М.Л., Кальяни К.Противораковая активность галловой кислоты в отношении линий раковых клеток, HCT-15 и MDA MB 231.
