Как самому приготовить раствор химического вещества (реактива)
Если на этой странице вам непонятно – сделали ещё более упрощённый вариант объяснения – перейти…
Но если и там вам будет сложно – тогда мы бессильны.
Большинство реактивов, которые продаются в химических магазинах, находятся в сухом виде. Однако используются они обычно в виде растворов. Поэтому один из самых частых вопросов от наших покупателей – как из сухого вещества сделать раствор нужной концентрации.
Напоминаем, что все работы с химическими веществами следует проводить с соблюдением необходимых мер безопасности! Используйте средства индивидуальной защиты органов дыхания, глаз и кожных покровов!
В зависимости от способа и методики приготовления растворы можно разделить на приблизительные и точные. Вторые можно приготовить только в лабораторных условиях с использованием дорогостоящего оборудования и посуды.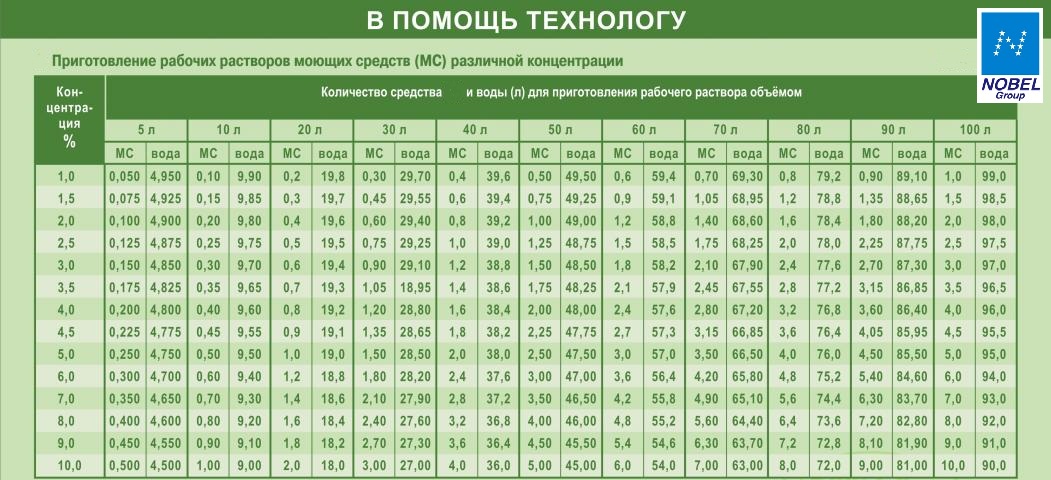
С другой стороны, “точности” приблизительных растворов вполне достаточно для проведения домашних опытов, удаления ржавчины или загрязнения, очистки или обеззараживания воды в аквариуме или в бассейне, для таких хобби, как химическая металлизация, печать фотографий, выращивание кристаллов, изготовления мыла и свечей и многих других.
Растворение химических веществ может производится в разных средах – воде, спирте, кислотах и т.д. В этой статье мы будем говорить только о растворении в воде.
Что такое концентрация раствора?
Концентрацию раствора выражают в процентах, например 10% раствор или 0,5% раствор. Эта цифра показывает, сколько частей вещества приходится на 100 частей раствора.
Так, в 100 граммах 10%-го раствора поваренной соли находится 10 грамм соли и 90 грамм воды. А в 500 граммах 30%-го раствора гидроксида натрия содержится 150 грамм NaOH и 350 грамм воды. Один килограмм 0,2%-го раствора нитрата серебра состоит из 2 грамм нитрата серебра и 998 грамм воды.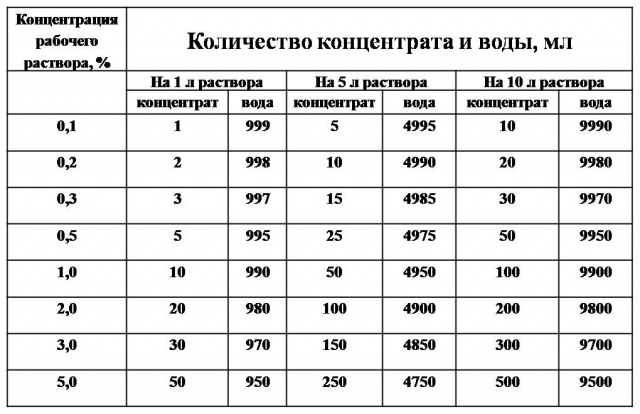
Отметим, что существует разница между массовой концентрацией и объемной концентрацией растворов, и эта разница тем больше, чем больше концентрация растворенного вещества и плотность раствора.
Например, чтобы приготовить 1 килограмм 15%-го раствора NaCl нужно смешать 150 грамм соли и 850 грамм воды. Для приготовления же 1 литра 15%-го раствора NaCl понадобится уже 166,2 грамм NaCl и 941,8 грамм воды (при растворении соли в воде объём раствора несколько увеличится), и плотность увеличится с 1,000 (на самом деле 0,998) до 1,108.
Объясняется такая разница тем, что плотность солевого раствора выше, чем плотность чистой воды.
В этой статье, для упрощения, речь всегда будет идти о массовой концентрации раствора, то есть вес раствора будем измерять в граммах, а не в миллилитрах.
Приготовление водного раствора из сухого безводного реактива
Прежде всего, определитесь – какой вес раствора вам понадобится. Если раствор этого вещества нестабилен или он вам нужен для какой-то разовой работы – готовьте столько раствора, сколько нужно сейчас. Если же раствор хорошо хранится и используется время от времени, можно приготовить его с запасом.
Если раствор этого вещества нестабилен или он вам нужен для какой-то разовой работы – готовьте столько раствора, сколько нужно сейчас. Если же раствор хорошо хранится и используется время от времени, можно приготовить его с запасом.
Теперь рассчитаем количество вещества, которое нужно взять для приготовления определенной массы раствора определённой концентрации:
Масса вещества в граммах = (концентрация раствора в процентах) * (масса раствора в граммах/100)
Соответственно, масса воды вычисляется как разница между общей массой раствора и массой сухого вещества.
Пример 1: приготовим 5%-й раствор гидроксида натрия (NaOH) массой 500 грамм.
Масса NaOH = (5) * (500 гр/100) = 25 грамм.
Масса воды = 475 грамм.
Пример 2: приготовим 37%-й раствор аммония фосфорнокислого (NH4H2PO4) массой 750 грамм.
Масса (NH4H2PO4) = (37) * (750 гр/100) = 277,5 грмм.
Масса воды = 472,5 грамм.
Остаётся растворить навеску сухого реактива в рассчитанном объёме воды.
Приготовление раствора из водных солей (кристаллогидратов)
Если вам нужно приготовить раствор из вещества, содержащего кристаллизационную воду (например, медный купорос CuSO4*5H2O, хромокалиевые квасцы KCr(SO4)2*12H2O и тому подобные вещества), то методика расчетов меняется, чтобы учесть уже имеющуюся в веществе воду.
Опять же, начинаем с определения массы раствора, который мы хотим приготовить. Затем вычисляем, сколько вещества должно содержаться в растворе такой массы нужной нам концентрации – формула та же, что и при использовании безводных реактивов.
Масса вещества в граммах = (концентрация раствора в процентах) * (масса раствора в граммах/100)
Далее, пересчитываем массу вещества на кристаллогидрат. Для этого в справочниках (Яндекс или Google – наше всё) находим молярные массы безводной формы этого вещества и кристаллогидрата и вычисляем соотношение – сколько вещества в безводной форме содержится в кристаллогидрате. Так, если молярная масса кристаллогидрата 150 грамм/моль, а безводная форма этого вещества имеет молярную массу 70 грамм/моль, это значит, что в 150 грамм кристаллогидрата содержатся 70 грамм безводной формы вещества.
Так, если молярная масса кристаллогидрата 150 грамм/моль, а безводная форма этого вещества имеет молярную массу 70 грамм/моль, это значит, что в 150 грамм кристаллогидрата содержатся 70 грамм безводной формы вещества.
Определив, какое количество кристаллогидрата вещества нам нужно растворить, вычисляем необходимую массу воды.
Пример 1. Приготовим 500 грамм 15%-го раствора карбоната натрия 10-водного Na 2CO3∙ 10H2O
Определяем массу карбоната натрия в 500 граммах 15%-го раствора:
Na2CO3 = (15) * (500 гр/100) = 75 грамм
Делаем пересчет массы на кристаллогидрат. Молярная масса Na2CO3 = 106 грамм/моль, молярная масса Na2CO3∙ 10H2O = 286 грамм/моль. Таким образом, 286 грамм карбоната натрия 10-водного содержат 106 грамм карбоната натрия безводного.
Нам нужно, чтобы в растворе оказалось 75 грамм карбоната натрия безводного. Составляем пропорцию и получаем, что нужно взять 202 грамма карбоната натрия 10-водного.
Составляем пропорцию и получаем, что нужно взять 202 грамма карбоната натрия 10-водного.
Последний шаг – посчитать нужное количество воды. 500 грамм минус 202 грамма = 298 грамм воды.
Пример 2. Приготовим 1000 грамм 3%-го раствора сульфата магния 7-водного MgSO4∙ 7H
Определяем массу сульфата магния в 1000 граммах 3%-го раствора:
MgSO4 = (3) * (1000 гр/100) = 30 грамм
Делаем пересчет массы на кристаллогидрат. Молярная масса (MgSO4) = 120 грамм/моль, молярная масса (MgSO4∙ 7H2O) = 246 грамм/моль.
Вычисляем, что для того, чтобы получить в растворе 30 грамм сульфата магния нужно взять 62 грамма сульфата магния 7-водного.
Смешиваем 938 грамм воды и 62 грамма сульфата магния 7-водного, получаем нужный результат.
Расчеты при приготовлении водных растворов
Приблизительные растворы.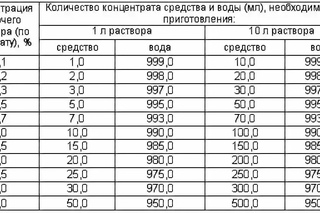 При приготовлении приблизительных растворов количества веществ, которые должны быть взяты для этого, вычисляют с небольшой точностью. Атомные веса элементов для упрощения расчетов допускается брать округленными иногда до целых единиц. Так, для грубого подсчета атомный вес железа можно принять равным 56 вместо точного —55,847; для серы — 32 вместо точного 32,064 и т. д.
При приготовлении приблизительных растворов количества веществ, которые должны быть взяты для этого, вычисляют с небольшой точностью. Атомные веса элементов для упрощения расчетов допускается брать округленными иногда до целых единиц. Так, для грубого подсчета атомный вес железа можно принять равным 56 вместо точного —55,847; для серы — 32 вместо точного 32,064 и т. д.
Вещества для приготовления приблизительных растворов взвешивают на технохимических или технических весах.
Принципиально расчеты при приготовлении растворов совершенно одинаковы для всех веществ.
Количество приготовляемого раствора выражают или в единицах массы (г, кг), или в единицах объема (мл, л), причем для каждого из этих случаев вычисление количества растворяемого вещества проводят по-разному.
Пример. Пусть требуется приготовить 1,5 кг 15%-ного раствора хлористого натрия; предварительно вычисляем требуемое количе-ство соли. Расчет проводится согласно пропорции:
т.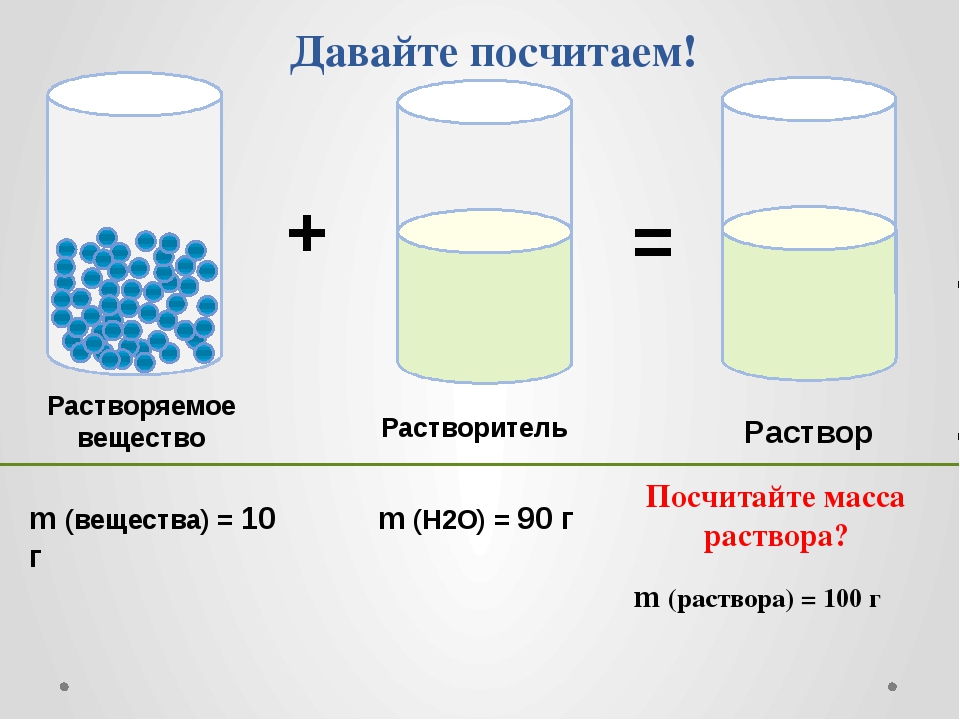
Расчет показывает, что нужно отвесить 225 г соли, тогда воды иужио взять 1500 — 225 = 1275 г. ¦
Если же задано получить 1,5 л того же раствора, то в этом случае по справочнику узнают его плотность, умножают последнюю на заданный объем и таким образом находят массу требуемого количества раствора. Так, плотность 15%-нoro раствора хлористого натрия при 15 0C равна 1,184 г/см3. Следовательно, 1500 мл составляет
Следовательно, количество вещества для приготовления 1,5 кг и 1,5 л раствора различно.
Расчет, приведенный выше, применим только для приготовления растворов безводных веществ. Если взята водная соль, например Na2SO4-IOh3O1 то расчет несколько видоизменяется, так как нужно принимать во внимание и кристаллизационную воду.
Пример. Пусть нужно приготовить 2 кг 10%-ного раствора Na2SO4, исходя из Na2SO4 *10h3O.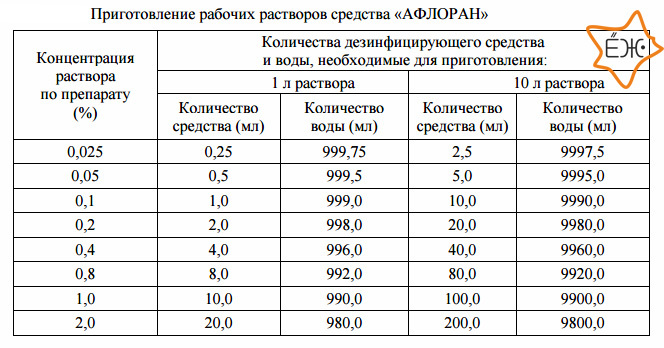
Молекулярный вес Na2SO4 равен 142,041, a Na2SO4*10h3O 322,195, или округленно 322,20.
Расчет ведут вначале па безводную соль:
Следовательно, нужно взять 200 г безводной соли. Количество десятиводной соли находят из расчета:
Воды в этом, случае нужно взять: 2000 — 453,7 =1546,3 г.
Так как раствор не всегда готовят с пересчетом на безводную соль, то на этикетке, которую обязательно следует наклеивать на сосуд с раствором, нужно указать, из какой соли приготовлен раствор, например 10%-ный раствор Na2SO4 или 25%-ный Na2SO4*10h3O.
Часто случается, что приготовленный ранее раствор нужно разбавить, т. е. уменьшить его концентрацию; растворы разбавляют или по объему, или по массе.
Пример. Нужно разбавить 20%-ный раствор сернокислого аммония так, чтобы получить 2 л 5%-иого раствора. Расчет ведем следующим путем. По справочнику узнаем, что плотность 5%-ного раствора (Nh5)2SO4 равна 1,0287 г/см3. Следовательно, 2 л его должны весить 1,0287*2000 = 2057,4 г.
Теперь можно подсчитать, сколько нужно взять 20%-ного рас* твора, чтобы получить 2 л 5%-ного раствора.
Полученную массу раствора можно пересчитать на объем его. Для этого массу раствора делят на его плотность (плотность 20%-ного раствора равна 1.1149 г/см3), т. е.
Учитывая, что при отмеривании могут произойти потери, нужно взять 462 мл и довести их до 2 л, т. е. добавить к ним 2000—462 = = 1538 мл воды.
Если же разбавление проводить по массе, расчет упрощается. Но вообще разбавление проводят из расчета на объем, так как жидкости, особенно в больших количествах, легче отмерить по объему, чем взвесить.
Нужно помнить, что при всякой работе как с растворением, так и с разбавлением никогда не следует выливать сразу всю воду в сосуд. Водой ополаскивают несколько раз ту посуду, в которой проводилось взвешивание или отмеривание нужного вещества, и каждый раз добавляют эту воду в сосуд для раствора.
Когда не требуется особенной точности, при разбавлении растворов или смешивании их для получения растворов другой концентрации можно пользоваться следующим простым и быстрым способом.
Возьмем разобранный уже случай разбавления 20%-ного раствора сернокислого аммония до 5%-ного. Пишем вначале так:
где 20 — концентрация взятого раствора, 0 — вода и 5’—-требуемая концентрация. Теперь из 20 вычитаем 5 и полученное значение пишем в правом нижнем углу, вычитая же нуль из 5, пишем цифру в правом верхнем углу. Тогда схема примет такой вид:
Это значит, что нужно взять 5 объемов 20%-ного раствора и 15 объемов воды. Конечно, такой расчет не отличается точностью.
Если смешивать два раствора одного и того же вещества, то схема сохраняется та же, изменяются только числовые значения. Пусть смешением 35%-ного раствора и 15%-ного нужно приготовить 25%-ный раствор. Тогда схема примет такой вид:
т. е. нужно взять по 10 объемов обоих растворов. Эта схема дает приблизительные результаты и ею можно пользоваться только тогда, когда особой точности не требуется.Для всякого химика очень важно воспитать в себе привычку к точности в вычислениях, когда это необходимо, и пользоваться приближенными цифрами в тех случаях, когда это не повлияет на результаты работы.Когда нужна большая точность при разбавлении растворов, вычисление проводят по формулам.
Эта схема дает приблизительные результаты и ею можно пользоваться только тогда, когда особой точности не требуется.Для всякого химика очень важно воспитать в себе привычку к точности в вычислениях, когда это необходимо, и пользоваться приближенными цифрами в тех случаях, когда это не повлияет на результаты работы.Когда нужна большая точность при разбавлении растворов, вычисление проводят по формулам.
Разберем несколько важнейших случаев.
Приготовление разбавленного раствора. Пусть с — количество раствора, m%—концентрация раствора, который нужно разбавить до концентрации п%. Получающееся при этом количество разбавленного раствора х вычисляют по формуле:
а объем воды v для разбавления раствора вычисляют по формуле:
Смешивание двух растворов одного и того же вещества различной концентрации для получения раствора заданной концентрации. Пусть смешиванием а частей m%-ного раствора с х частями п%-ного раствора нужно получить /%-ный раствор, тогда:
Точные растворы. При приготовлении точных растворов вычисление количеств нужных веществ проверят уже с достаточной степенью точности. Атомные весы элементов берут по таблице, в которой приведены их точные значения. При сложении (или вычитании) пользуются точным значением слагаемого с наименьшим числом десятичных знаков. Остальные слагаемые округляют, оставляя после запятой одним знаком больше, чем в слагаемом с наименьшим числом знаков. В результате оставляют столько цифр после запятой, сколько их имеется в слагаемом с наименьшим числом десятичных знаков; при этом производят необходимое округление. Все расчеты производят, применяя логарифмы, пятизначные или четырехзначные. Вычисленные количества вещества отвешивают только на аналитических весах.
При приготовлении точных растворов вычисление количеств нужных веществ проверят уже с достаточной степенью точности. Атомные весы элементов берут по таблице, в которой приведены их точные значения. При сложении (или вычитании) пользуются точным значением слагаемого с наименьшим числом десятичных знаков. Остальные слагаемые округляют, оставляя после запятой одним знаком больше, чем в слагаемом с наименьшим числом знаков. В результате оставляют столько цифр после запятой, сколько их имеется в слагаемом с наименьшим числом десятичных знаков; при этом производят необходимое округление. Все расчеты производят, применяя логарифмы, пятизначные или четырехзначные. Вычисленные количества вещества отвешивают только на аналитических весах.
Взвешивание проводят или на часовом стекле, или в бюксе. Отвешенное вещество высыпают в чисто вымытую мерную колбу через чистую сухую воронку небольшими порциями. Затем из промывалки несколько раз небольшими порциями воды обмывают над воронкой бнже или часовое стекло, в котором проводилось взвешивание. Воронку также несколько раз обмывают из промывалки дистиллированной водой.
Воронку также несколько раз обмывают из промывалки дистиллированной водой.
Для пересыпания твердых кристаллов или порошков в мерную колбу очень удобно пользоваться воронкой, изображенной на рис. 349. Такие воронки изготовляют емкостью 3, 6, и 10 см3. Взвешивать навеску можно непосредственно в этих воронках (негигроскопические материалы), предварительно определив их массу. Навеска из воронки очень легко переводится в мерную колбу. Когда навеска пересыпается, воронку, не вынимая из горла колбы, хорошо обмывают дистиллированной водой из промывалки.
Как правило, при приготовлении точных растворов и переведении растворяемого вещества в мерную колбу растворитель (например, вода) должен занимать не более половины емкости колбы. Закрыв пробкой мерную колбу, встряхивают ее до полного растворения твердого вещества. После этого полученный раствор дополняют водой до метки и тщательно перемешивают.
Молярные растворы. Для приготовления 1 л 1 M раствора какого-либо вещества отвешивают на аналитических весах 1 моль его и растворяют, как указано выше.
Пример. Для приготовления 1 л 1 M раствора азотнокислого серебра находят в таблице или подсчитывают молекулярную массу AgNO3, она равна 169,875. Соль отвешивают и растворяют в воде.
Если нужно приготовить более разбавленный раствор (0,1 или 0,01 M), отвешивают соответственно 0,1 или 0,01 моль соли.
Если же нужно приготовить меньше 1 л раствора, то растворяют соответственно меньшее количество соли в соответствущем объеме воды.
Нормальные растворы готовят аналогично, только отвешивая не 1 моль, а 1 грамм-эквивалент твердого вещества.
Если нужно приготовить полунормальный или децинормальный раствор, берут соответственно 0,5 или 0,1 грамм-эквивалента. Когда готовят не 1 л раствора, а меньше, например 100 или 250 мл, то берут1/10 или 1/4 того количества вещества, которое требуется для приготовления I л, и растворяют в соответствующем объеме воды.
Рис 349. Воронки для пересыпания навески а колбу.
После приготовления раствора его нужно обязательно проверить титрованием соответствующим раствором другого вещества с известной нормальностью. Приготовленный раствор может не отвечать точно той нормальности, которая задана. В таких случаях иногда вводят поправку.
Приготовленный раствор может не отвечать точно той нормальности, которая задана. В таких случаях иногда вводят поправку.
В производственных лабораториях иногда готовят точные растворы «по определяемому веществу». Применение таких растворов облегчает расчеты при анализах, так как достаточно умножить объем раствора, пошедший на титрование, на титр раствора, чтобы получить содержание искомого вещества (в г) во взятом для анализа количестве какого-либо раствора.
Расчет при приготовлении титрованного раствора по определяемому веществу ведут также по грамм-эквиваленту растворяемого вещества, пользуясь формулой:
Пример. Пусть нужно приготовить 3 л раствора марганцовокислого калия с титром по железу 0,0050 г/мл. Грамм-эквивалент KMnO4 равен 31,61., а грамм-эквивалент Fe 55,847.
Вычисляем по приведенной выше формуле:
Стандартные растворы. Стандартными называют растворы с разными, точно определенными концентрациями, применяемые в колориметрии, например растворы, содержащие в 1 мл 0,1, 0,01, 0,001 мг и т. д. растворенного вещества.
д. растворенного вещества.
Кроме колориметрического анализа, такие растворы бывают нужны при определении рН, при нефелометрических определениях и пр. Иногда стандартные растворы» хранят в запаянных ампулах, однако чаще приходится готовить их непосредственно перед применением. Стандартные растворы готовят в объеме не больше 1 л, а ча ще — меньше. Только при большом расходе стандартного раствори можно готовить несколько литров его и то при условии, что стандартный раствор не будет храниться длительный срок.
Количество вещества (в г), необходимое для получения таких растворов, вычисляют по формуле:
Пример. Нужно приготовить стандартные растворы CuSO4 • 5h3O для колориметрического определения меди, причем в 1 мл первого раствора должно содержаться 1 мг меди, второго — 0,1 мг, третьего —0,01 мг, четвертого — 0,001 мг. Вначале готовят достаточное количество первого раствора, например 100 мл.
В данном случае Mi = 249,68; АСu = 63,54; следовательно, для приготовления 100 мл раствора, 1 мл которого содержал бы 1 мг меди (Т = 0,001 г/мл), нужно взять
Навеску соли переносят в мерную колбу емкостью 100 мл и добавляют воду до метки. Другие растворы готовят соответствующим разбавлением приготовленного.
Другие растворы готовят соответствующим разбавлением приготовленного.
Эмпирические растворы. Концентрацию этих растворов чаще всего выражают в г/л или г/мл. Для приготовления эмпирических растворов применяют очищенные перекристаллизацией вещества или реактивы квалификации ч. д. а. или х. ч.
Пример. Нужно приготовить 0,5 л раствора CuSO4, содержашего Cu 10 мг/мл. Для приготовления раствора применяют CuSO4 • 5h3O.
Чтобы подсчитать, сколько следует взять этой солн для приготовления раствора заданного объема, подсчитывают, сколько Cu должно содержаться в нем. Для этого объем умножают на заданную концентрацию, т. е.
500*10 = 5000 мг, или 5,0000 г
После этого, зная молекулярный вес соли, подсчитывают нужное количество ее:
На аналитических весах отвешивают в бюксе точно 19,648 г чистой соли, переводят ее в мерную колбу емкостью 0,5 л. Растворение проводят, как указано выше.
К оглавлению
см. также
также
- Основные понятия о растворах
- Классификация растворов
- Концентрация растворов
- Техника приготовления растворов
- Расчеты при приготовлении водных растворов
- Растворы солей
- Растворы щелочей
- Растворы кислот
- Фиксаналы
- Некоторые замечания о титровании и точных растворах
- Расчеты при титровании с помощью весовых бюреток
- Рациональные величины
- Растворение жидкостей
- Растворение газов
- Индикаторы
- Автоматическое титрование
- Неводные растворы
- Растворение в органических растворителях
- Обесцвечивание растворов
Как приготовить рабочий раствор дезсредства различной концентрации
В зависимости от целей дезинфекции готовые растворы применяют различной концентрации. Для приготовления таких растворов используется растворение необходимого количества средства в воде. Рассмотрим процесс приготовления на примере дезинфицирующего средства «Велтоцид», часто применяемого в различных отраслях.
Для приготовления таких растворов используется растворение необходимого количества средства в воде. Рассмотрим процесс приготовления на примере дезинфицирующего средства «Велтоцид», часто применяемого в различных отраслях.
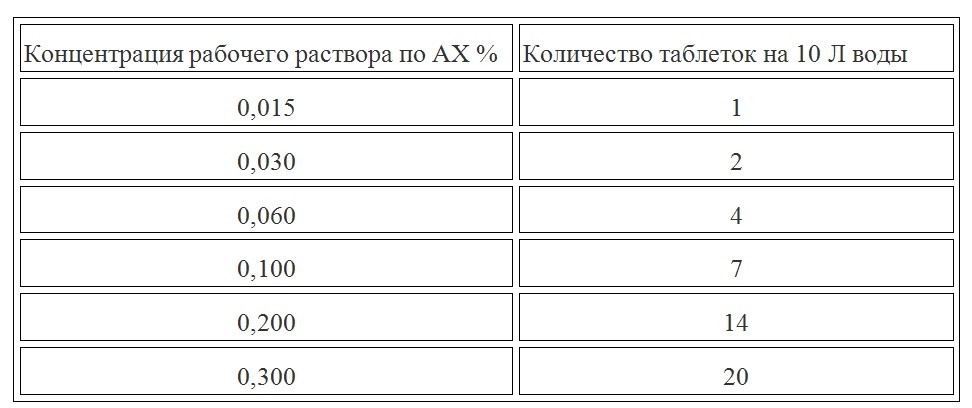
В салонах красоты, для профилактической дезинфекции, генеральной уборки, используют данное средство 0.1% рабочего раствора. В то же время, во время эпидемий инфекционных заболеваний, салоны красоты используют «Велтоцид» в других концентрациях:
Обьекты дезинфекции | Концентрация рабочего раствора % |
|---|---|
| Поверхности в помещении | 0,25 |
| Косметический инструментарий | 0,5 |
Алгоритмы приготовления рабочего раствора:
1. Используя дезраствор, надо четко определить, для какого вида обработки он необходим, или это генеральная уборка или активная обработка в период обострений заболеваний – для каждого процесса концентрация и время экспозиции средства будет свое.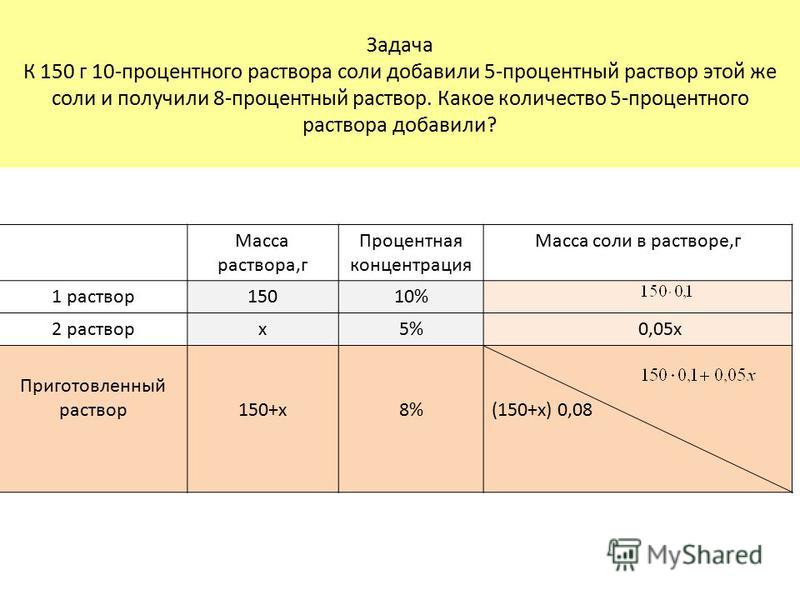
2. Готовить дезсредство и проводить дезинфекцию в организации должен подготовленный специалист, ответственность которого регламентируется журналом учета получения и расходования дезсредств в организации.
3. В процессе работы с активным веществом важно соблюдать технику безопасности: работать в хорошо проветриваемом помещении, с защитой кожи, глаз и дыхательных путей с помощью марлевых повязок или респираторов. Чистые сухие емкости, используемые для приготовления раствора, должны маркироваться датой и временем приготовления, а далее – храниться в сухом и недоступном для общего пользования месте.
4. Для работы понадобятся:
- Пластиковые или эмалированные контейнеры с плотно прилегающей крышкой;
- Перчатки, марлевая повязка, респиратор, в некоторых случаях очки;
- Мерная тара;
- Ложка для смешивания;
- Чистая и холодная вода;
- Концентрат дезинфицирующего средства.
5. Пропорции соблюдаются согласно инструкциям и записываются на контейнере в процентном соотношении. В первую очередь в тару наливают воду, затем добавляют дезинфектант, тщательно перемешивая. Затем маркируют и ставят подпись лица, приготовившего раствор.
В первую очередь в тару наливают воду, затем добавляют дезинфектант, тщательно перемешивая. Затем маркируют и ставят подпись лица, приготовившего раствор.
Как правило, необходимые пропорции концентрата дезсредства и воды, для приготовления готового дезинфицирующего раствора, можно найти в инструкции, непосредственно на сайте поставщика:
Концентрация в процентах — это обьем в мл концентрата дезсредства, содержащегося в общем обьеме готового рабочего дезинфицирующего раствора.
Т.е. 1 литр 1% рабочего раствора Велтоцида, это 10мл концентрата Велтоцида растворенного в 990 мл воды
Для удобства в работе применяют готовые таблицы, по которым можно подобрать необходимую концентрацию:
ВАЖНО! После приготовления раствора, специалист должен выбросить защитные средства и тщательно промыть руки с использованием антисептического средства. Такая предосторожность позволит удалить мельчайшие частички концентрата с кожи, и избежать отравления организма.
Если у вас остались вопросы,
Вам нужна дополнительная консультация
Звоните по тел:
8(8452) 68-17-28
WhatsApp: 89272244113
сайт: http://pakcentr.ru
E-mail:Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
ООО «ПАК-Центр»
Если вам понравилась статья и информация оказалась полезной, пожалуйста, поделитесь с теми, кто только еще приступает к поиску необходимого дезинфицирующего средства.
Как приготовить 0.1 процентный раствор. Как приготовить раствор
Не все помнят, что значит «концентрация» и как правильно приготовить раствор. Если вы хотите получить 1-процентный раствор любого вещества, то растворяете 10 г вещества в литре воды (или 100 г в 10 литрах). Соответственно, 2-процентный раствор содержит 20 г вещества в литре воды (200 г в 10 литрах) и так далее.
Если отмерить маленькое количество сложно, берите большее, готовьте так называемый маточный раствор и затем разбавляйте его. Берем 10 граммов, готовим литр 1-процентного раствора, отливаем 100 мл, доводим их до литра водой (разбавляем в 10 раз), и 0,1-процентный раствор готов.
Берем 10 граммов, готовим литр 1-процентного раствора, отливаем 100 мл, доводим их до литра водой (разбавляем в 10 раз), и 0,1-процентный раствор готов.
Как сделать раствор медного купороса
Чтобы приготовить 10 литров медно-мыльной эмульсии нужно приготовить 150-200 г мыла и 9 литров воды (лучше дождевой). Отдельно 5-10 г медного купороса растворяем в 1 литре воды. После этого раствор медного купороса тонкой струёй добавляют в мыльный раствор, при этом не переставая хорошо перемешивать. В результате получится жидкость зеленоватого цвета. Если плохо смешивать или поспешить, то образуются хлопья. В этом случае процесс лучше начать с самого начала.
Как приготовить 5 процентный раствор марганцовки
Чтобы приготовить 5% раствор нужно 5 г марганцовки и 100 мл воды. Первым делом наливаем воду в приготовленную ёмкость, следом добавляем кристаллы. Затем все это перемешать до равномерного и насыщенного фиолетового окраса жидкости. Перед использованием рекомендуется процедить раствор через марлю, чтобы удалить нерастворённые кристаллы.
Как приготовить 5 процентный раствор мочевины
Мочевина является высококонцентрированным азотным удобрением. При этом гранулы вещества легко растворяются в воде. Чтобы сделать 5% раствор нужно взять 50 г мочевины и 1 л воды или 500 г гранул удобрения на 10 л воды. В ёмкость с водой добавляют гранулы и хорошо перемешивают.
При приготовлении растворов процентной концентрации вещество отвешивают на техно-химических весах, а жид- I кости отмеривают мерным цилиндром. Поэтому навеску! вещества рассчитывают с точностью до 0,1 г, а объем 1 жидкости с точностью до 1 мл.
Прежде чем приступить к приготовлению раствора, | необходимо произвести расчет, т. е. рассчитать количество растворяемого вещества и растворителя для приготовления определенного количества раствора заданной концентрации.
РАСЧЕТЫ ПРИ ПРИГОТОВЛЕНИИ РАСТВОРОВ СОЛЕЙ
Пример 1. Надо приготовить 500 г 5% раствора нитЯ рата калия. 100 г такого раствора содержат 5 г KN0 3 ;1 Составляем пропорцию:
100 г раствора-5 г KN0 3
500 » 1 — х » KN0 3
5-500
„_ х= -jQg- = 25 г.
Воды нужно взять 500-25 = 475 мл.
Пример 2. Надо приготовить 500 г 5% раствора СаСЬ из соли СаС1 2 -6Н 2 0. Вначале производим расчет для безводной соли.
100 г раствора-5 г СаС1 2 500 » » —х » СаС1 2 5-500 _ х= 100 = 25 г —
Мольная масса СаС1 2 = 111, мольная масса СаС1 2 — 6Н 2 0 = 219*. Следовательно, 219 г СаС1 2 -6Н 2 0 содержат 111 г СаС1 2 . Составляем пропорцию:
219 г СаС1 2 -6Н 2 0-111 г СаС1 2
х » СаС1 2 -6Н 2 0- 26 » CaCI,
219-25 х = -jjj- = 49,3 г.
Количество воды равно 500-49,3=450,7 г, или 450,7 мл. Так как воду отмеривают мерным цилиндром, то десятые доли миллилитра в расчет не принимают. Следовательно, нужно отмерить 451 мл воды.
РАСЧЕТЫ ПРИ ПРИГОТОВЛЕНИИ РАСТВОРОВ КИСЛОТ
При приготовлении растворов кислот необходимо учитывать, что концентрированные растворы кислот не являются 100% и содержат воду. Кроме того, нужное количество кислоты не отвешивают, а отмеривают мерным цилиндром.
Пример 1. Нужно приготовить 500 г 10% раствора соляной кислоты, исходя из имеющейся 58% кислоты, плотность которой d=l,19.
1. Находим количество чистого хлористого водорода, которое должно быть в приготовленном растворе кислоты:
100 г раствора -10 г НС1 500 » » — х » НС1 500-10 * = 100 = 50 г —
* Для расчета растворов процентной концентрации мольную, массу округляют до целых чисел.
2. Находим количество граммов концентрированной }
кислоты, в котором будет находиться 50 г НС1:
100 г кислоты-38 г НС1 х » » -50 » НС1 100 50
X gg— » = 131 ,6 Г.
3. Находим объем, который занимает это количество 1
кислоты:
V — — — 131 ‘ 6 110 6 щ
4. Количество растворителя (воды) равно 500-;
-131,6 = 368,4 г, или 368,4 мл. Так как необходимое ко-
личество воды и кислоты отмеривают мерным цилинд-
ром, то десятые доли миллилитра в расчет не принима-
ют. Следовательно, для приготовления 500 г 10% раство-
Следовательно, для приготовления 500 г 10% раство-
ра соляной кислоты необходимо взять 111 мл соляной I
кислоты и 368 мл воды.
Пример 2. Обычно при расчетах для приготовления кислот пользуются стандартными таблицами, в которых указаны процент раствора кислоты, плотность данного раствора при определенной температуре и количество граммов этой кислоты, содержащееся в 1 л раствора данной концентрации (см. приложение V). В этом случае расчет упрощается. Количество приготовляемого раствора кислоты может быть рассчитано на определенный объем.
Например, нужно приготовить 500 мл 10% раствора соляной кислоты, исходя из концентрированного 38% j раствора. По таблицам находим, что 10% раствор соляной кислоты содержит 104,7 г НС1 в 1 л раствора. Нам I нужно приготовить 500 мл, следовательно, в растворе должно быть 104,7:2 = 52,35 г НО.
Вычислим, сколько нужно взять концентрированной I кислоты. По таблице 1 л концентрированной НС1 содержит 451,6 г НС1. Составляем пропорцию: 1000 мл-451,6 г НС1 х » -52,35 » НС1
1000-52,35 х = 451,6 =»5 мл.
Количество воды равно 500-115 = 385 мл.
Следовательно, для приготовления 500 мл 10% раствора соляной кислоты нужно взять 115 мл концентрированного раствора НС1 и 385 мл воды.
На вопрос подскажите как сделать 1% раствор с медным купоросом и известью (или кальцинированой содой) заданный автором Larysa lymar лучший ответ это С кальцинированной содой бордосскую жидкость не готовят. Кальцинированная сода-это карбонат натрия, а Вам нужен гидроксид кальция (гашеная известь) . Иначе малахит получите. Как готовить-читайте:
Ответ от Муджтахид. [гуру]
Ответ от Пространщик [гуру]
Ответ от Двутавровый [гуру]
Ответ от Особый [гуру]
для приготовления 1%-го раствора по меди нужно 100 г купороса развести в 10 л воды и нейтрализовать 100 г гашеной извести ==>>
Ответ от Natali Natali [гуру]
Ответ от Жанна С [гуру]
1-% БОРДОССКАЯ смесь.
и также разбавляют 5 л воды.
(по зеленым листьям) .
1-% БУРГУНДСКая жидкость
Добавляют 50 г. хоз. мыла.
МЕДНО_МЫЛЬНЫЙ РАСТВОР.
+мыло в таком же количестве.
Успеха в борьбе с болезнями)
Ответ от Муджтахид. [гуру]
Купите лучше уже готовую Бордоскую жидкость.
Ответ от Галина русскова (чуркина) GALJ [гуру]
ОБРАБАТЫВАЮТ РАСТЕНИЯ ОТ ФИТОФТОРЫ ДРУГИХ БОЛЕЗНЕЙ
Ответ от Елена Акентьева [гуру]
Не мучайтесь с бордосской смесью, очень неудобный препарат в плане приготовления (плохо смешивается) и обработки (забивает опрыскиватель) . Купите Ордан или Абига-Пик, замечательные фунгициды, никакой мороки.
Ответ от Костенко Сергей [гуру]
для приготовления 1%-го раствора по меди нужно 100 г купороса развести в 10 л воды и нейтрализовать 100 г гашеной извести ==>> 10 л бордоски с концентрацией по меди 1%
Ответ от Natali Natali [гуру]
В 5 литрах теплой воды развести 100г медного купороса и отдельно в 5 литрах воды развести 100г извести. Потом раствор купороса ВЛИТЬ в раствор извести — НЕ наоборот и получите 1% раствор бордосской жидкости. Иначе говоря: на 10л воды — по 100г купороса и извести
Потом раствор купороса ВЛИТЬ в раствор извести — НЕ наоборот и получите 1% раствор бордосской жидкости. Иначе говоря: на 10л воды — по 100г купороса и извести
Ответ от Жанна С [гуру]
БОРДОССКАЯ смесь готовится на основе медного купороса и извести.
БУРГУНДСКАЯ-из медного купороса и соды (можно и пищевой) +мыло.
1-% БОРДОССКАЯ смесь.
100 г негашеной извести и гасят в небольшом количестве воды, разбавляют водой до 5 литров, получают известковое молоко.
В другой посуде (неметаллической)
растворяют в горячей воде 100 г медного купороса
и также разбавляют 5 л воды.
В известковое молоко вливают раствор медного купороса и хорошо размешивают.
Медь в известь, а не наоборот!
Можно растворить 100 г медного купороса в 1 л горячей воды
и влить, постепенно помешивая, в 9 л известкового молока.
Но смешивать оба концентрированных раствора,
а затем разбавлять водой до 10 л недопустимо.
Получается смесь плохого качества.
Правильно приготовленная жидкость имеет бирюзовый, небесно-синий цвет и нейтральную или слабощелочную реакцию.
Кислотность проверяют лакмусовой бумагой,
которая окрашивается в синий цвет.
Можно опустить в раствор любую чистую (не ржавую) железку.
В кислой среде медь активно оседает на железе.
Кислая смесь будет обжигать листья.
Ее нейтрализуют добавлением известкового молока.
1-процентную смесь применяют по вегетирующим растениям
(по зеленым листьям) .
1-% БУРГУНДСКая жидкость
100 г медного купороса и 100 г кальцинированной соды на 10 л воды. Растворяют по отдельности,
сливают вместе, проверяют кислотность,
т. е. готовят так же как бордоскую смесь, только известь заменяют содой.
Добавляют 50 г. хоз. мыла.
МЕДНО_МЫЛЬНЫЙ РАСТВОР.
в 0,5 л горячей воды растворяют 10 г медного купороса.
Отдельно в 10 л воды (лучше теплой) разводят 100 г мыла.
Раствор медного купороса тонкой струей при постоянном перемешивании вливают в раствор мыла.
Препарат готовят перед началом опрыскивания.
Медно-мыльный препарат (эмульсию) можно готовить и в более высоких концентрациях
(20 г медного купороса и 200 г мыла
или 30 г купороса и 300 г мыла на 10 л воды) .
Правильно приготовленная эмульсия должна иметь зеленоватый цвет и не образовывать хлопьев.
Чтобы избежать свертывания препарата в случаи приготовления его в жесткой воде,
следует уменьшить количество медного купороса
или добавить к воде 0,5% (50 г на 10 л воды) кальцинированной (бельевой) соды.
Можно применять совместно с карбофосом (20 г на 10 л эмульсии)
для одновременной борьбы с тлями и паутинными клещами.
КАЛЬЦИНИРОВАННАЯ, или бельевая, сода (карбонат натрия) — белый кристаллический порошок, растворимый в воде.
Применяют для борьбы с мучнисторосяными грибами,
в концентрации 0,5% (50 г на 10 л воды) .
+мыло в таком же количестве.
Для приготовления рабочего раствора разводят мыло в мягкой воде и добавляют соду, предварительно растворенную в небольшом количестве воды.
Успеха в борьбе с болезнями)
(получить из более концентрированного раствора менее концентрированный)
1 действие:
Количество мл более концентрированного раствора (который необходимо развести)
Необходимый объем в мл (который необходимо приготовить)
Концентрация менее концентрированного раствора (того, который необходимо получить)
Концентрация более концентрированного раствора (того, который разводим)
2 действие:
Количество мл воды (или разбавителя) = или воды до (ad) необходимого объема ()
Задача№6. Во флаконе ампициллина находится 0,5 сухого лекарственного средства. Сколько нужно взять растворителя, чтобы в 0,5 мл раствора было 0,1 г сухого вещества.
Во флаконе ампициллина находится 0,5 сухого лекарственного средства. Сколько нужно взять растворителя, чтобы в 0,5 мл раствора было 0,1 г сухого вещества.
Решение: при разведении антибиотика на 0,1 г сухого порошка берут 0,5 мл растворителя, следовательно, если,
0,1 г сухого вещества – 0,5 мл растворителя
0,5 г сухого вещества — х мл растворителя
получаем:
Ответ: чтобы в 0,5 мл раствора было 0,1 г сухого вещества необходимо взять 2,5 мл растворителя.
Задача № 7. Во флаконе пенициллина находится 1 млн. ЕД сухого лекарственного средства. Сколько нужно взять растворителя, чтобы в 0,5 мл раствора было 100000 ЕД сухого вещества.
Решение: 100000 ЕД сухого вещества – 0,5 мл сухого вещества, тогда в 100000 ЕД сухого вещества –0,5 мл сухого вещества.
1000000 ЕД – х
Ответ: чтобы в 0,5 мл раствора было 100000ЕД сухого вещества необходимо взять 5 мл растворителя.
Задача № 8. Во флаконе оксацилина находится 0,25 сухого лекарственного средства. Сколько нужно взять растворителя, чтобы в 1 мл раствора было 0,1 г сухого вещества
Решение:
1 мл раствора – 0,1г
х мл — 0,25 г
Ответ: чтобы в 1 мл раствора было 0,1 г сухого вещества нужно взять 2,5 мл растворителя.
Задача №9 . Цена деления инсулинового шприца – 4 ЕД. Скольким делениям шприца соответствует 28 ЕД. инсулина? 36 ЕД.? 52 ЕД.?
Решение: Для того, чтобы узнать скольким делениям шприца соответствует 28 ЕД. инсулина необходимо: 28:4 =7(делениям).
Аналогично: 36:4=9(делениям)
52:4=13(делениям)
Ответ: 7, 9, 13 делениям.
Задача № 10 . Сколько нужно взять 10% раствора осветленной хлорной извести и воды (в литрах) для приготовления 10л 5%раствора.
Решение:
1) 100 г – 5г
(г) активного вещества
2) 100% – 10г
(мл) 10% раствора
3) 10000-5000=5000 (мл) воды
Ответ: необходимо взять 5000мл осветленной хлорной извести и 5000мл воды.
Задача № 11 . Сколько нужно взять 10% раствора хлорной извести и воды для приготовления 5л 1% раствора.
Решение:
Так как в 100 мл содержится 10 г активного вещества то,
1) 100г – 1мл
5000 мл – х
(мл) активного вещества
2) 100% – 10мл
00 (мл) 10% раствора
3) 5000-500=4500 (мл) воды.
Ответ: необходимо взять 500 мл 10% раствора и 4500мл воды.
Задача № 12 . Сколько нужно взять 10% раствора хлорной извести и воды для приготовления 2л 0,5% раствора.
Решение:
Так как в 100 мл содержится 10 мл активного вещества то,
1) 100 % – 0,5мл
0 (мл) активного вещества
2) 100 % – 10 мл
(мл) 10% раствора
3) 2000-100=1900 (мл) воды.
Ответ: необходимо взять 10 мл 10% раствора и 1900 мл воды.
Задача № 13 . Сколько нужно взять хлорамина (сухое вещество) в г и воды для приготовления 1 литра 3%раствора.
Решение:
1) 3г – 100 мл
г
2) 10000 – 300=9700мл.
Ответ: для приготовления 10 литров 3%раствора необходимо взять 300г хлорамина и 9700мл воды.
Задача № 14. Сколько нужно взять хлорамина (сухого) в г и воды для приготовления 3-х литров 0,5% раствора.
Решение:
Процент – количество вещества в 100 мл.
1) 0,5 г – 100 мл
г
2) 3000 – 15=2985мл.
Ответ: для приготовления 10 литров 3%раствора необходимо взять 15г хлорамина и 2985мл воды
Задача № 15. Сколько нужно взять хлорамина (сухого) в г и воды для приготовления 5 литров 3% раствора.
Решение:
Процент – количество вещества в 100 мл.
1) 3 г – 100 мл
г
2) 5000 – 150= 4850мл.
Ответ: для приготовления 5 литров 3%раствора необходимо взять 150г хлорамина и 4850 мл воды.
Задача № 16 . Для постановки согревающего компресса из 40% раствора этилового спирта необходимо взять 50мл. Сколько нужно взять 96% спирта для постановки согревающего компресса?
Сколько нужно взять 96% спирта для постановки согревающего компресса?
Решение:
По формуле (1)
мл
Ответ: Для приготовления согревающего компресса из 96% раствора этилового спирта необходимо взять 21 мл.
Задача № 17 . Приготовить 1 литр 1% раствор хлорной извести для обработки инвентаря из 1 литра маточного 10% раствора.
Решение: Подсчитайте сколько нужно взять мл 10% раствора для приготовления 1% раствора:
10г – 1000 мл
Ответ: Чтобы приготовить 1 литр 1% раствора хлорной извести нужно взять 100 мл 10% раствора и добавить 900 мл воды.
Задача № 18. Больной должен принимать лекарство по 1 мг в порошках 4 раза в день в течении 7 дней, то сколько необходимо выписать данного лекарства (расчет вести в граммах).
Решение: 1г = 1000мг, следовательно, 1 мг = 0,001 г.
Подсчитайте сколько больному необходимо лекарства в день:
4* 0,001 г = 0,004 г, следовательно, на 7 дней ему необходимо:
7* 0,004 г = 0,028 г.
Ответ: данного лекарства необходимо выписать 0,028 г.
Задача № 19. Больному необходимо ввести 400 тысяч единиц пенициллина. Флакон по 1 миллиону единиц. Развести 1:1. Сколько мл раствора необходимо взять.
Решение: При разведении 1:1 в 1 мл раствора содержится 100 тысяч единиц действия. 1 флакон пенициллина по 1 миллиону единиц разводим10 мл раствора. Если больному необходимо ввести 400 тысяч единиц, то необходимо взять 4 мл полученного раствора.
Ответ: необходимо взять 4 мл полученного раствора.
Задача № 20. Ввести больному 24 единицы инсулина. Цена деления шприца 0,1 мл.
Решение: в 1 мл инсулина содержится 40 единиц инсулина. В 0,1 мл инсулина содержится 4 единицы инсулина. Чтобы ввести больному 24 единицы инсулина необходимо взять 0,6 мл инсулина.
Приблизительные растворы. При приготовлении приблизительных растворов количества веществ, которые должны быть взяты для этого, вычисляют с небольшой точностью. Атомные веса элементов для упрощения расчетов допускается брать округленными иногда до целых единиц. Так, для грубого подсчета атомный вес железа можно принять равным 56 вместо точного -55,847; для серы — 32 вместо точного 32,064 и т. д.
Атомные веса элементов для упрощения расчетов допускается брать округленными иногда до целых единиц. Так, для грубого подсчета атомный вес железа можно принять равным 56 вместо точного -55,847; для серы — 32 вместо точного 32,064 и т. д.
Вещества для приготовления приблизительных растворов взвешивают на технохимических или технических весах.
Принципиально расчеты при приготовлении растворов совершенно одинаковы для всех веществ.
Количество приготовляемого раствора выражают или в единицах массы (г, кг), или в единицах объема (мл, л), причем для каждого из этих случаев вычисление количества растворяемого вещества проводят по-разному.
Пример. Пусть требуется приготовить 1,5 кг 15%-ного раствора хлористого натрия; предварительно вычисляем требуемое количе-ство соли. Расчет проводится согласно пропорции:
т. е. если в 100 г раствора содержится 15 г соли (15%), то сколько ее потребуется для приготовления 1500 г раствора?
Расчет показывает, что нужно отвесить 225 г соли, тогда воды иужио взять 1500 — 225 = 1275 г. ¦
¦
Если же задано получить 1,5 л того же раствора, то в этом случае по справочнику узнают его плотность, умножают последнюю на заданный объем и таким образом находят массу требуемого количества раствора. Так, плотность 15%-нoro раствора хлористого натрия при 15 0C равна 1,184 г/см3. Следовательно, 1500 мл составляет
Следовательно, количество вещества для приготовления 1,5 кг и 1,5 л раствора различно.
Расчет, приведенный выше, применим только для приготовления растворов безводных веществ. Если взята водная соль, например Na2SO4-IOh3O1 то расчет несколько видоизменяется, так как нужно принимать во внимание и кристаллизационную воду.
Пример. Пусть нужно приготовить 2 кг 10%-ного раствора Na2SO4, исходя из Na2SO4 *10h3O.
Молекулярный вес Na2SO4 равен 142,041, a Na2SO4*10h3O 322,195, или округленно 322,20.
Расчет ведут вначале па безводную соль:
Следовательно, нужно взять 200 г безводной соли. Количество десятиводной соли находят из расчета:
Воды в этом, случае нужно взять: 2000 — 453,7 =1546,3 г.
Так как раствор не всегда готовят с пересчетом на безводную соль, то на этикетке, которую обязательно следует наклеивать на сосуд с раствором, нужно указать, из какой соли приготовлен раствор, например 10%-ный раствор Na2SO4 или 25%-ный Na2SO4*10h3O.
Часто случается, что приготовленный ранее раствор нужно разбавить, т. е. уменьшить его концентрацию; растворы разбавляют или по объему, или по массе.
Пример. Нужно разбавить 20%-ный раствор сернокислого аммония так, чтобы получить 2 л 5%-иого раствора. Расчет ведем следующим путем. По справочнику узнаем, что плотность 5%-ного раствора (Nh5)2SO4 равна 1,0287 г/см3. Следовательно, 2 л его должны весить 1,0287*2000 = 2057,4 г. В этом количестве должно находиться сернокислого аммония:
Учитывая, что при отмеривании могут произойти потери, нужно взять 462 мл и довести их до 2 л, т. е. добавить к ним 2000-462 = = 1538 мл воды.
Если же разбавление проводить по массе, расчет упрощается. Но вообще разбавление проводят из расчета на объем, так как жидкости, особенно в больших количествах, легче отмерить по объему, чем взвесить.
Нужно помнить, что при всякой работе как с растворением, так и с разбавлением никогда не следует выливать сразу всю воду в сосуд. Водой ополаскивают несколько раз ту посуду, в которой проводилось взвешивание или отмеривание нужного вещества, и каждый раз добавляют эту воду в сосуд для раствора.
Когда не требуется особенной точности, при разбавлении растворов или смешивании их для получения растворов другой концентрации можно пользоваться следующим простым и быстрым способом.
Возьмем разобранный уже случай разбавления 20%-ного раствора сернокислого аммония до 5%-ного. Пишем вначале так:
где 20 — концентрация взятого раствора, 0 — вода и 5″—требуемая концентрация. Теперь из 20 вычитаем 5 и полученное значение пишем в правом нижнем углу, вычитая же нуль из 5, пишем цифру в правом верхнем углу. Тогда схема примет такой вид:
Это значит, что нужно взять 5 объемов 20%-ного раствора и 15 объемов воды. Конечно, такой расчет не отличается точностью.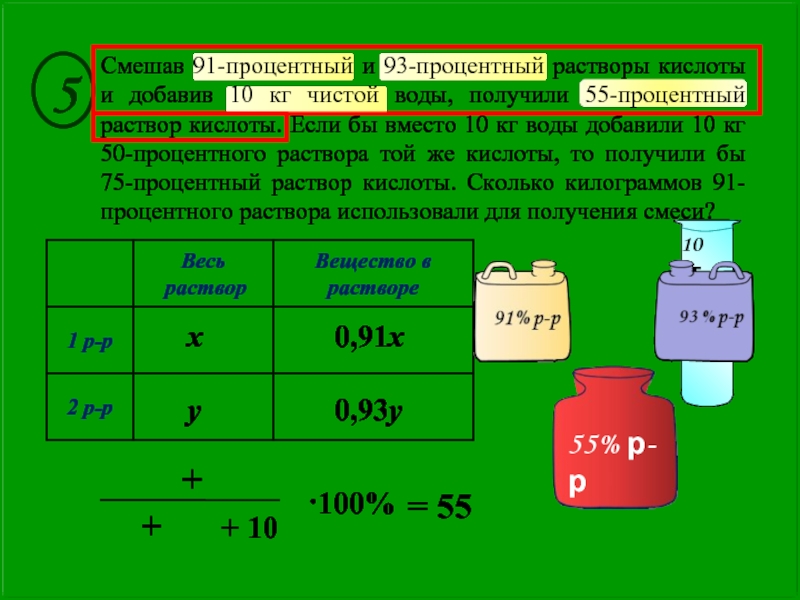
Если смешивать два раствора одного и того же вещества, то схема сохраняется та же, изменяются только числовые значения. Пусть смешением 35%-ного раствора и 15%-ного нужно приготовить 25%-ный раствор. Тогда схема примет такой вид:
т. е. нужно взять по 10 объемов обоих растворов. Эта схема дает приблизительные результаты и ею можно пользоваться только тогда, когда особой точности не требуется.Для всякого химика очень важно воспитать в себе привычку к точности в вычислениях, когда это необходимо, и пользоваться приближенными цифрами в тех случаях, когда это не повлияет на результаты работы.Когда нужна большая точность при разбавлении растворов, вычисление проводят по формулам.
Разберем несколько важнейших случаев.
Приготовление разбавленного раствора . Пусть с — количество раствора, m%-концентрация раствора, который нужно разбавить до концентрации п%. Получающееся при этом количество разбавленного раствора х вычисляют по формуле:
а объем воды v для разбавления раствора вычисляют по формуле:
Смешивание двух растворов одного и того же вещества различной концентрации для получения раствора заданной концентрации. Пусть смешиванием а частей m%-ного раствора с х частями п%-ного раствора нужно получить /%-ный раствор, тогда:
Пусть смешиванием а частей m%-ного раствора с х частями п%-ного раствора нужно получить /%-ный раствор, тогда:
Точные растворы. При приготовлении точных растворов вычисление количеств нужных веществ проверят уже с достаточной степенью точности. Атомные весы элементов берут по таблице, в которой приведены их точные значения. При сложении (или вычитании) пользуются точным значением слагаемого с наименьшим числом десятичных знаков. Остальные слагаемые округляют, оставляя после запятой одним знаком больше, чем в слагаемом с наименьшим числом знаков. В результате оставляют столько цифр после запятой, сколько их имеется в слагаемом с наименьшим числом десятичных знаков; при этом производят необходимое округление. Все расчеты производят, применяя логарифмы, пятизначные или четырехзначные. Вычисленные количества вещества отвешивают только на аналитических весах.
Взвешивание проводят или на часовом стекле, или в бюксе. Отвешенное вещество высыпают в чисто вымытую мерную колбу через чистую сухую воронку небольшими порциями. Затем из промывалки несколько раз небольшими порциями воды обмывают над воронкой бнже или часовое стекло, в котором проводилось взвешивание. Воронку также несколько раз обмывают из промывалки дистиллированной водой.
Затем из промывалки несколько раз небольшими порциями воды обмывают над воронкой бнже или часовое стекло, в котором проводилось взвешивание. Воронку также несколько раз обмывают из промывалки дистиллированной водой.
Для пересыпания твердых кристаллов или порошков в мерную колбу очень удобно пользоваться воронкой, изображенной на рис. 349. Такие воронки изготовляют емкостью 3, 6, и 10 см3. Взвешивать навеску можно непосредственно в этих воронках (негигроскопические материалы), предварительно определив их массу. Навеска из воронки очень легко переводится в мерную колбу. Когда навеска пересыпается, воронку, не вынимая из горла колбы, хорошо обмывают дистиллированной водой из промывалки.
Как правило, при приготовлении точных растворов и переведении растворяемого вещества в мерную колбу растворитель (например, вода) должен занимать не более половины емкости колбы. Закрыв пробкой мерную колбу, встряхивают ее до полного растворения твердого вещества. После этого полученный раствор дополняют водой до метки и тщательно перемешивают.
Молярные растворы. Для приготовления 1 л 1 M раствора какого-либо вещества отвешивают на аналитических весах 1 моль его и растворяют, как указано выше.
Пример. Для приготовления 1 л 1 M раствора азотнокислого серебра находят в таблице или подсчитывают молекулярную массу AgNO3, она равна 169,875. Соль отвешивают и растворяют в воде.
Если нужно приготовить более разбавленный раствор (0,1 или 0,01 M), отвешивают соответственно 0,1 или 0,01 моль соли.
Если же нужно приготовить меньше 1 л раствора, то растворяют соответственно меньшее количество соли в соответствущем объеме воды.
Нормальные растворы готовят аналогично, только отвешивая не 1 моль, а 1 грамм-эквивалент твердого вещества.
Если нужно приготовить полунормальный или децинормальный раствор, берут соответственно 0,5 или 0,1 грамм-эквивалента. Когда готовят не 1 л раствора, а меньше, например 100 или 250 мл, то берут1/10 или 1/4 того количества вещества, которое требуется для приготовления I л, и растворяют в соответствующем объеме воды.
Рис 349. Воронки для пересыпания навески а колбу.
После приготовления раствора его нужно обязательно проверить титрованием соответствующим раствором другого вещества с известной нормальностью. Приготовленный раствор может не отвечать точно той нормальности, которая задана. В таких случаях иногда вводят поправку.
В производственных лабораториях иногда готовят точные растворы «по определяемому веществу». Применение таких растворов облегчает расчеты при анализах, так как достаточно умножить объем раствора, пошедший на титрование, на титр раствора, чтобы получить содержание искомого вещества (в г) во взятом для анализа количестве какого-либо раствора.
Расчет при приготовлении титрованного раствора по определяемому веществу ведут также по грамм-эквиваленту растворяемого вещества, пользуясь формулой:
Пример. Пусть нужно приготовить 3 л раствора марганцовокислого калия с титром по железу 0,0050 г/мл. Грамм-эквивалент KMnO4 равен 31,61., а грамм-эквивалент Fe 55,847.
Вычисляем по приведенной выше формуле:
Стандартные растворы. Стандартными называют растворы с разными, точно определенными концентрациями, применяемые в колориметрии, например растворы, содержащие в 1 мл 0,1, 0,01, 0,001 мг и т. д. растворенного вещества.
Кроме колориметрического анализа, такие растворы бывают нужны при определении рН, при нефелометрических определениях и пр. Иногда стандартные растворы» хранят в запаянных ампулах, однако чаще приходится готовить их непосредственно перед применением. Стандартные растворы готовят в объеме не больше 1 л, а ча ще — меньше. Только при большом расходе стандартного раствори можно готовить несколько литров его и то при условии, что стандартный раствор не будет храниться длительный срок.
Количество вещества (в г), необходимое для получения таких растворов, вычисляют по формуле:
Пример. Нужно приготовить стандартные растворы CuSO4 5h3O для колориметрического определения меди, причем в 1 мл первого раствора должно содержаться 1 мг меди, второго — 0,1 мг, третьего -0,01 мг, четвертого — 0,001 мг. Вначале готовят достаточное количество первого раствора, например 100 мл.
Вначале готовят достаточное количество первого раствора, например 100 мл.
Приготовление процентных растворов.
Процентным раствором называют раствор, содержащий в своем составе определенный процент вещества по массе пли объему. Например, 50%-ный раствор NaOH содержит 50 г химически чистого NaOH в 100 г раствора (процент к массе) или 60%-ный раствор спирта содержит 60 мл безводного спирта на 100 мл раствора.
Пример. Необходимо приготовить 1 л 5%-ного раствора НС1 при плотности 1,19.
По таблице узнаем, что 5%-ный раствор НС1 имеет плотпость 1,024. Тогда 1 л ее будет весить 1,024-1000=1024 г.
В этом количестве должно содержаться чистого хлористого водорода:
Кислота с плотностью 1,19 содержит 37,23% НС1. Исходное вещество находим по таблице.
Чтобы узнать, сколько нужно взять кислоты, составляем пропорцию:
иликислоты с плотностью 1,19.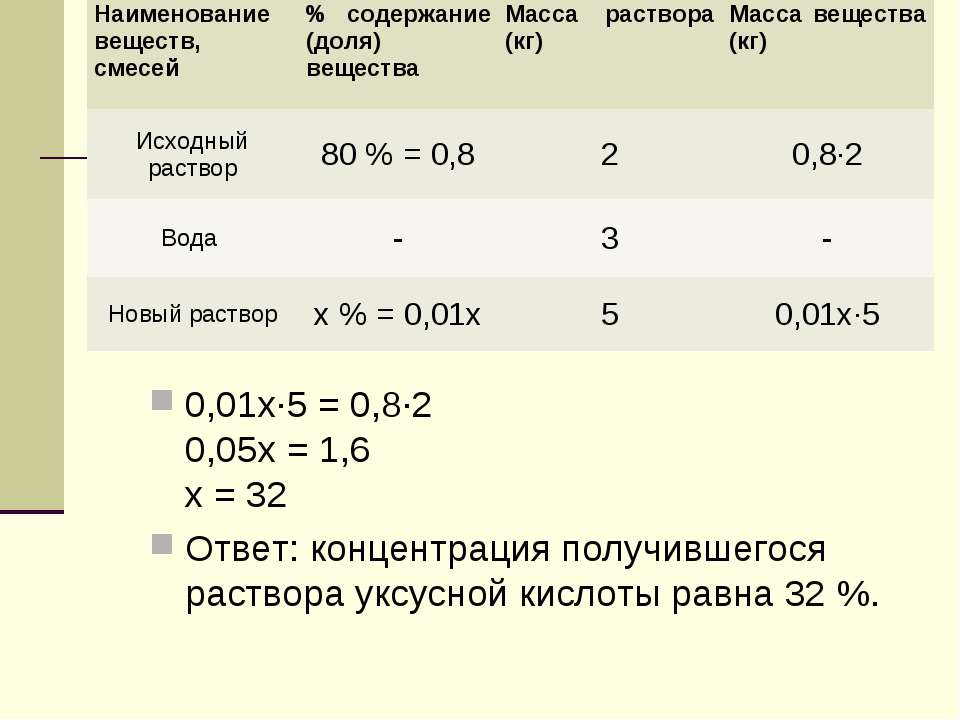 Отмерив 116 мл кислоты, доводим ее объем до 1 л.
Отмерив 116 мл кислоты, доводим ее объем до 1 л.
Таким же образом рассчитываем и серную кислоту.
Таблица 33
Исходное вещество | Плотность | Весовой процент исходного вещества | 25% | 20% | 10% | 5% | 2% | 1% |
НС1 H2S04 HN03 | 1,19 1,84 1,40 | 37,23 95,6 65,6 | 634,8 167,7 313,0 | 496,6 129,9 243,6 | 236,8 60,6 115,0 | 115,5 29,3 56,0 | 45,5 11,5 22,0 | 22,6 5,6 10,8 |
Для облегчения расчета в таблице 33 приведено количество исходных веществ для приготовления процентных растворов кислот.
Дезинфицирующий раствор — как приготовить в домашних условиях
Использование дезсредств
Многие дезсредства производятся в виде концентрата. Из концентратов уже готовят рабочие растворы дезинфицирующих средств путем добавления в них воды. Далее полученным раствором обрабатывают предметы и поверхности. Инструменты, посуду, белье и пр. дезинфицируют методом погружения. Дезинфекцию больших поверхностей (к примеру, пола, стен, мебели) проводят путем протирания, реже орошения.
Как же понять, какая именно концентрация рабочих растворов дезинфицирующих средств необходима для обработки? Прежде всего, нужно отталкиваться от того, на каком именно объекте и по какому режиму будет осуществляться дезинфекция. Всего существует четыре режима дезинфекции:
- Режим при бактериальных инфекциях, кроме туберкулеза;
- Режим при туберкулезе;
- Режим при грибковых заболеваниях;
- Режим при вирусных заболеваниях.

Дезрежим определяется исходя из эпидемиологической опасности объекта. Так, в общественных заведениях (торговых центрах, учебных учреждениях и т.д.) дезинфекцию осуществляют по бактериальному режиму. А дезинфекцию медицинских и маникюрных инструментов проводят по режиму при вирусных заболеваниях.
На практике дезинфекция при различных режимах отличается концентрацией рабочего раствора и временем экспозиции. Например, для обработки предметов по режиму при вирусных заболеваниях используют более концентрированный раствор и большую экспозицию по сравнению с обработкой при бактериальных заболеваниях.
В инструкции к каждому дезсредству есть таблицы с указанием того, какой концентрации рабочий раствор использовать и какая необходима экспозиция при обработке тех или иных предметов при разных режимах.
Приготовление растворов дезинфицирующих моющих средств
После определения подходящей концентрации рабочего раствора дезсредства, приступают к его приготовлению. Все манипуляции должны проводиться с использованием средств личной зашиты — обязательно надевают перчатки, а при необходимости еще и респираторы с очками. Приготовление и хранение дезсредств проводят в отдельной технической комнате, недоступной для посторонних.
Все манипуляции должны проводиться с использованием средств личной зашиты — обязательно надевают перчатки, а при необходимости еще и респираторы с очками. Приготовление и хранение дезсредств проводят в отдельной технической комнате, недоступной для посторонних.
Прежде всего, необходимо приготовить посуду, это может эмалированная, пластиковая или стеклянная тара. В посуду наливают необходимое количество холодной питьевой воды. А затем уже к воде добавляют концентрированное дезсредство, отмеряя его мерным колпачком или стаканчиком. Тару с готовым водным раствором дезинфицирующего средства закрывают крышкой, и на наклейке указывают всю информацию: название и концентрацию раствора, дату его приготовления со сроком годности, а также ФИО приготовившего сотрудника.
Как же приготовить дезраствор необходимой концентрации? Для этого можно воспользоваться универсальной таблицей:
| Концентрация рабочего раствора | 1 литр рабочего раствора | |
| Кол-во средства | Кол-во воды | |
| 0,2 | 2,0 | 998,0 |
| 0,5 | 5,0 | 995,0 |
| 1,0 | 10,0 | 990,0 |
| 1,5 | 15,0 | 985,0 |
| 2,0 | 20,0 | 980,0 |
| 2,5 | 25,0 | 975,0 |
| 3,0 | 30,0 | 970,0 |
| 5,0 | 50,0 | 950,0 |
| 10,0 | 100,0 | 900,0 |
| 15,0 | 150,0 | 850,0 |
| 20,0 | 200,0 | 800,0 |
| 25,0 | 250,0 | 750,0 |
Ориентируясь на эту таблицу можно легко рассчитать пропорции для приготовления любого объема рабочего раствора необходимой концентрации.
Рассмотрим особенности приготовления дезсредства на следующем примере. Необходимо приготовить 10 литров 1-процентного рабочего раствора. Для этого в емкость необходимо налить 9900,0 мл воды, а затем к воде добавить 100 мл дезсредства. В итоге получается рабочий раствор объемом 10 литров.
Во время приготовления рабочих растворов моющих и дезинфицирующих средств чрезвычайно важно соблюдать необходимые пропорции. Так, часто сотрудники допускают следующую ошибку: наливают в емкость 10 литров воды, затем 100 мл дезсредства. В итоге получается объем 10,1 литров, а это неправильно, ведь концентрация рабочего раствора уже не будет 1-процентной.
Техника безопасности
Руководителю учреждения нужно помнить о том, что именно он несет ответственность за здоровье сотрудников. А поэтому все сотрудники, работающие с дезсредствами, должны пройти подробный инструктаж по безопасности. Согласно санитарным нормам, к работе с дезсредствами не допускаются несовершеннолетние лица, а также люди с аллергическими заболеваниями. Сотрудники должны иметь санитарную книжку и ежегодно проходить профосмотры.
Согласно санитарным нормам, к работе с дезсредствами не допускаются несовершеннолетние лица, а также люди с аллергическими заболеваниями. Сотрудники должны иметь санитарную книжку и ежегодно проходить профосмотры.
Во время работы с дезсредствами обязательно нужно пользоваться средствами защиты, предоставить которые обязан руководитель учреждения. При этом стоит избегать попадания дезсредства на открытые участки тела. При работе с дезсредствами запрещается пить и есть. По завершению работы сотруднику необходимо вымыть руки с мылом.
При попадании дезсредства на кожу или в глаза сразу же нужно промыть их проточной водой. Также на такой случай руководитель обязан разместить в помещении аптечку, которая будет доступна каждому сотруднику.
Вернуться к списку публикаций
Раствор для дезинфекции — приготовление дезинфицирующего раствора
Самый частый вопрос, который покупатели задают в чат поддержки нашего интернет-магазина — как правильно приготовить рабочий раствор дезинфицирующего средства. С этим вопросом обычно обращаются рядовые потребители, поэтому будет уместным собрать всю информацию по данному вопросу в один обзор.
С этим вопросом обычно обращаются рядовые потребители, поэтому будет уместным собрать всю информацию по данному вопросу в один обзор.
Для начала хотелось бы обратить Ваше внимание на следующее: Всегда строго следуйте инструкции к дезинфицирующему средству!
В инструкции указываются те требования к приготовлению рабочих растворов дезинфицирующих средств, которые производитель посчитал важными для конкретного дезсредства.
Производители дезсредств придерживаются некоторых общих правил, которые справедливы для приготовления рабочих растворов практических всех дезинфицирующих средств. Например:
- Посуда для должна быть химически нейтральна, чистой, без следов ржавчины. Обычно это эмалированная посуда (без повреждения эмали), стеклянные или пластмассовые ёмкости
- Для приготовления обычно используют чистую холодную питьевую воду. Если производитель требует дистиллированную воду, то это будет обязательно указано в инструкции к раствору для дезинфекций.

- Некоторые препараты, могут быть использованы не только в виде водного раствора, но в виде водно-спиртового. Для приготовления таких дезсредств используют не 2 компонента, а 3.
- К работе не допускаются лица моложе 18 лет и не страдающие аллергическими заболеваниями и повышенной чувствительностью к химическим веществам.
- При работе со средством кожу рук необходимо защищать резиновыми перчатками.
- Мерная посуда должна быть чистой, сухой и химически нейтральной. Весьма желательно пользоваться раздельной посудой для каждого компонента рабочего раствора.
- При всех работах следует избегать попадания средства в глаза и на кожу.
Ключевое понятие для приготовления рабочего раствора дезинфицирующего средства — концентрация, которая подразумевает долю дезсредства в общем объеме рабочего раствора. Обратите внимание, что обычно концентрация дезсредства для разных режимов обработки и разных обрабатываемых поверхностей отличаются, порой — существенно. Концентрация — понятие относительное и поэтому справедливо для любого дезинфицирующего средства, то есть 1%-ный рабочий раствор препарата Альфадез, Миродез или любого иного означает, что в составе присутствует 1/100 часть дезинфицирующего средства и 99/100 частей воды.
Концентрация — понятие относительное и поэтому справедливо для любого дезинфицирующего средства, то есть 1%-ный рабочий раствор препарата Альфадез, Миродез или любого иного означает, что в составе присутствует 1/100 часть дезинфицирующего средства и 99/100 частей воды.
Ниже приведена универсальная таблица для приготовления рабочих растворов для дезинфекции в диапазоне 0,1% — 4%. Иные концентрации можно высчитать из данных таблица по правилам обычной пропорции.
Концентрация рабочих растворов дезинфицирующих средств
|
Концентрация рабочего раствора (%) по препарату |
Количество концентрата средства и воды (мл), необходимые для приготовления: |
|||
|
1 л раствора |
10 л раствора |
|||
|
средство |
вода |
средство |
вода |
|
|
0,1 |
1,0 |
999,0 |
10 |
9990 |
|
0,2 |
2,0 |
998,0 |
20 |
9980 |
|
0,3 |
3,0 |
997,0 |
30 |
9970 |
|
0,4 |
4,0 |
996,0 |
40 |
9960 |
|
0,5 |
5,0 |
995,0 |
50 |
9950 |
|
0,8 |
8,0 |
992,0 |
80 |
9920 |
|
1,0 |
10,0 |
990,0 |
100 |
9900 |
|
1,2 |
12,0 |
988,0 |
120 |
9880 |
|
1,5 |
15,0 |
985,0 |
150 |
9850 |
|
2,0 |
20,0 |
980,0 |
200 |
9800 |
|
2,5 |
25,0 |
975,0 |
250 |
9750 |
|
3,0 |
30,0 |
970,0 |
300 |
9700 |
|
3,5 |
35,0 |
965,0 |
350 |
9650 |
|
4,0 |
40,0 |
960,0 |
400 |
9600 |
После приготовления рабочего раствора дезинфицирующего средства рекомендуется проверить концентрацию дезсредства с помощью соответствующих индикаторных полосок. Сами индикаторные полоски не входят в комплект поставки дезинфицирующего средства, их можно купить отдельно в нашем интернет-магазине.
Сами индикаторные полоски не входят в комплект поставки дезинфицирующего средства, их можно купить отдельно в нашем интернет-магазине.
Внимательно читайте и следуйте инструкции при приготовлении рабочего раствора дезинфицирующего средства!
Задать интересующие Вас вопросы, а также купить дезинфицирующие средства в Москве с доставкой, Вы можете в нашем интернет-магазине по телефону или через онлайн-чат.
Если вы уже знаете, как приготовить рабочий раствор дезсредства, то вам будет интересно узнать, как провести дезинфекцию парикмахерских или маникюрных инструментов.
Подготовка химических растворов
Лабораторные эксперименты и виды исследований часто требуют приготовления химических растворов. Мы рассмотрим приготовление этих химических растворов по весу (вес / объем) и по объему (об / об). В приведенном ниже глоссарии приведены определения, чтобы знать, когда в вашей работе требуются эти и наиболее точные решения для моляров.
К этому мы добавляем информацию, предназначенную для понимания того, как использовать шкалу pH при измерении кислотности или щелочности раствора.
Глоссарий, основные термины для понимания …
Solute — Вещество, растворяющееся в растворе
Растворитель — Вещество, растворяющее другое вещество с образованием раствора. Например, в растворе сахара и воды растворителем является вода; сахар — это растворенное вещество.
Раствор — смесь двух или более чистых веществ. В растворе одно чистое вещество гомогенно растворяется в другом чистом веществе. Например, в растворе сахара и воды раствор имеет одинаковую концентрацию повсюду, т.е.он однородный.
Моль — основная единица массы (например, «дюжина» для пекаря), используемая химиками. Этот термин относится к большому количеству элементарных частиц (атомов, молекул, ионов, электронов и т. Д.) Любого вещества. 1 моль — это 6,02 x 10 23 молекулы этого вещества. (Номер Авогадро) .M
Введение в приготовление растворов.
Многие эксперименты с химическими веществами требуют их использования в виде раствора. То есть два или более веществ смешиваются вместе в известных количествах.Это может включать взвешивание точного количества сухого материала или измерение точного количества жидкости. Точная подготовка решений повысит безопасность эксперимента и его шансы на успех.
То есть два или более веществ смешиваются вместе в известных количествах.Это может включать взвешивание точного количества сухого материала или измерение точного количества жидкости. Точная подготовка решений повысит безопасность эксперимента и его шансы на успех.
Решение 1. Использование процентного содержания по весу (мас. / Об.)
Формула
Формула для массового процента (вес / объем): [Масса растворенного вещества (г) / Объем раствора (мл)] x 100
Пример
10% раствор NaCl содержит десять граммов хлорида натрия, растворенных в 100 мл раствора.
Процедура
Вес 10 г хлорида натрия. Перелейте его в мерный цилиндр или мерную колбу, содержащую около 80 мл воды. После полного растворения хлорида натрия (при необходимости осторожно перемешайте колбу) добавьте воды, чтобы довести объем до конечных 100 мл. Внимание: не просто отмерьте на 100 мл воды и добавьте 10 г хлорида натрия. Это приведет к ошибке, поскольку добавление твердого вещества изменит конечный объем раствора и снизит окончательный процент.
Это приведет к ошибке, поскольку добавление твердого вещества изменит конечный объем раствора и снизит окончательный процент.
Решение 2. Использование процентного содержания по объему (об. / Об.)
Когда растворенное вещество представляет собой жидкость, иногда удобно выражать концентрацию раствора в объемных процентах.
Формула
Формула для объемного процента (об. / Об.): [Объем растворенного вещества (мл) / Объем раствора (мл)] x 100
Пример
Сделайте 1000 мл 5% -ного по объему раствора этиленгликоля в воде.
Процедура
Во-первых, выразите процент растворенного вещества в виде десятичной дроби: 5% = 0.05
Умножьте это десятичное число на общий объем: 0,05 x 1000 мл = 50 мл (необходим этиленгликоль).
Вычтите объем растворенного вещества (этиленгликоля) из общего объема раствора:
1000 мл (общий объем раствора) — 50 мл (объем этиленгликоля) = 950 мл (требуется вода)
Растворите 50 мл этиленгликоля в чуть менее 950 мл воды. Теперь доведите конечный объем раствора до , 1000 мл, , добавив еще воды.(Это устраняет любую ошибку, поскольку конечный объем раствора может не равняться расчетной сумме отдельных компонентов).
Теперь доведите конечный объем раствора до , 1000 мл, , добавив еще воды.(Это устраняет любую ошибку, поскольку конечный объем раствора может не равняться расчетной сумме отдельных компонентов).
Итак, 50 мл этиленгликоля / 1000 мл раствора x100 = 5% (об. / Об.) Раствор этиленгликоля.
Раствор 3: молярные растворы
Молярные растворы являются наиболее полезными при расчетах химических реакций, поскольку они напрямую связывают количество молей растворенного вещества с объемом раствора.
Формула
Формула молярности (M): моль растворенного вещества / 1 литр раствора или грамм-молекулярная масса растворенного вещества / 1 литр раствора.
Примеры
Молекулярная масса молекулы хлорида натрия (NaCl) составляет 58,44, поэтому молекулярная масса в граммах (= 1 моль) равна 58,44 г. Мы знаем это, глядя на таблицу Менделеева. Атомная масса (или вес) Na составляет 22,99, атомная масса Cl составляет 35,45, поэтому 22,99 + 35,45 = 58,44.
Если вы растворите 58,44 г NaCl в конечном объеме 1 литр , вы получите раствор 1M NaCl , 1 молярный раствор.
Процедура
Для получения молярных растворов NaCl других концентраций разбавьте массу соли до 1000 мл раствора следующим образом:
0.Для 1M раствора NaCl требуется 0,1 x 58,44 г NaCl = 5,844 г
0,5 М раствор NaCl требуется 0,5 x 58,44 г NaCl = 29,22 г
2M раствор NaCl требуется 2,0 x 58,44 г NaCl = 116,88 г
Калькуляторпроцентов (%) решений — PhysiologyWeb
Расчет процентов (%) решений
Предназначенный для использования как в учебной, так и в исследовательской лаборатории, этот калькулятор (см. Ниже) может использоваться для выполнения ряда различных расчетов для приготовления процентов (%) растворов , начиная с твердого или жидкого материала. Очень часто концентрацию растворов выражают в процентах. Процент означает на 100 частей, где для растворов часть означает меру массы (мкг, мг, г, кг и т. Д.) Или объема (мкл, мл, л и т. Д.). В процентах растворов количество (вес или объем) растворенного вещества выражается в процентах от общего веса или объема раствора. Процентные растворы могут иметь форму % вес / объем (% вес / объем или% вес / объем), % вес / вес (% вес / вес или% вес / вес) или % вес / объем (об. / об.% или об. / об.%).В каждом случае процентная концентрация рассчитывается как доля массы или объема растворенного вещества, относящаяся к общей массе или объему раствора.
Очень часто концентрацию растворов выражают в процентах. Процент означает на 100 частей, где для растворов часть означает меру массы (мкг, мг, г, кг и т. Д.) Или объема (мкл, мл, л и т. Д.). В процентах растворов количество (вес или объем) растворенного вещества выражается в процентах от общего веса или объема раствора. Процентные растворы могут иметь форму % вес / объем (% вес / объем или% вес / объем), % вес / вес (% вес / вес или% вес / вес) или % вес / объем (об. / об.% или об. / об.%).В каждом случае процентная концентрация рассчитывается как доля массы или объема растворенного вещества, относящаяся к общей массе или объему раствора.
Поскольку процентные решения могут быть выражены тремя различными способами, совершенно необходимо явно указать тип процентного решения. Если эта информация не предоставлена, конечному пользователю остается «угадать», было ли использовано вес / объем%, вес / вес% или объем / объем%. Каждое процентное решение подходит для ряда различных приложений. Например, коммерческие водные реагенты, такие как концентрированные кислоты и основания, обычно выражаются в виде растворов в процентах по массе. Например, коммерчески доступная концентрированная соляная кислота (HCl) составляет 37% по массе (% мас. / Мас.). С другой стороны, многие разбавленные растворы, используемые для биологических исследований, выражаются в процентах по массе / объему (например, 1% додецилсульфат натрия, SDS). Объем / объем% растворенных веществ также являются обычными и используются, когда используются чистые растворенные вещества в жидкой форме. Например, 70% (об. / Об.) Раствор этанола можно приготовить растворением 70 мл 100% (т.е.е., 200 доказательств) этанола в общем объеме раствора 100 мл.
Например, коммерческие водные реагенты, такие как концентрированные кислоты и основания, обычно выражаются в виде растворов в процентах по массе. Например, коммерчески доступная концентрированная соляная кислота (HCl) составляет 37% по массе (% мас. / Мас.). С другой стороны, многие разбавленные растворы, используемые для биологических исследований, выражаются в процентах по массе / объему (например, 1% додецилсульфат натрия, SDS). Объем / объем% растворенных веществ также являются обычными и используются, когда используются чистые растворенные вещества в жидкой форме. Например, 70% (об. / Об.) Раствор этанола можно приготовить растворением 70 мл 100% (т.е.е., 200 доказательств) этанола в общем объеме раствора 100 мл.
Другие факторы также могут быть важны при выборе типа процентного раствора для приготовления. Например, если рассматриваемый процентный раствор должен использоваться при сильно различающихся температурах, то лучше приготовить раствор в виде раствора в процентах по весу, поскольку его концентрация не будет зависеть от изменений температуры окружающей среды.
Сделаем важное замечание. Здесь мы использовали «вес» вместо «масса» просто для того, чтобы соответствовать традициям и популярному использованию.Таким образом, растворов масс. / Об.% Следует правильно обозначать как масс. / Об.% . Точно так же растворы масс. / Масс.% следует обозначать как масс / масс.% или просто масс.% .
Процентное решение уравнений
| (уравнение 1) | |
| (Ур.2) | |
| (уравнение 3) |
Как отмечалось выше, вес относится к массе (т.е. измеряется на весах). При изучении уравнения для каждого из приведенных выше процентных соотношений очень важно отметить, что во всех случаях знаменатель относится к массе или объему раствора , а не только к массе или объему растворителя. Таким образом, масса раствора — это объединенная масса растворенного вещества и растворителя, а объем раствора — это объединенный объем растворенного вещества и растворителя.
Таким образом, масса раствора — это объединенная масса растворенного вещества и растворителя, а объем раствора — это объединенный объем растворенного вещества и растворителя.
Последнее замечание необходимо при рассмотрении решений объем / объем%. Когда разные объемы идентичного раствора складываются вместе, конечный объем всегда будет в точности суммой отдельных добавленных порций. Например, добавление 50 мл воды к 50 мл воды приведет к общему объему 100 мл, а добавление 75 мл 100% этанола к 75 мл 100% этанола приведет к общему объему 150 мл.Однако при смешивании смешиваемых жидкостей (таких как вода и этанол) конечный объем раствора не точно равен сумме отдельных объемов. Например, добавление 50 мл этанола к 50 мл воды приведет к получению общего объема менее 100 мл. На самом деле это ближе к 96 мл. Следовательно, при приготовлении растворов объем / объемный процент всегда лучше растворять растворенное вещество в растворителе, а затем добавлять дополнительный растворитель, чтобы довести общий объем раствора до желаемого конечного значения.
Калькулятор процентного решения
Каждая ячейка калькулятора, показанная ниже, соответствует члену в приведенной выше формуле. Введите соответствующие значения во все ячейки, кроме той, которую вы хотите вычислить. Следовательно, по крайней мере две ячейки должны иметь значения, и не более одной ячейки может быть пустой. . Значение пустой ячейки будет рассчитано на основе других введенных значений. После выполнения вычисления вычисленная ячейка будет выделена, и последующие вычисления будут вычислять значение выделенной ячейки (без требования иметь пустую ячейку).Однако пустая ячейка имеет приоритет над выделенной ячейкой.
Комментарии и / или инструкции по приготовлению
Размещено: 5 октября 2013 г., суббота
Последнее обновление: 23 декабря 2017 г., суббота
Предположим
что кто-то уже проработал детали,
так что все, что вам нужно сделать, это прочитать формулу
и принять решение. Конечно, бывают исключения. Вес / вес (в / в) решенияПожалуй, самый простой способ описать решение в единицах веса-веса (вес / вес). Вес растворенного вещества относительно веса окончательное решение описывается в процентах.Например, предположим, что у вас есть растворимый краситель. в спирте. Вместо того, чтобы писать инструкции, «возьмите 3 грамма красителя и смешать с 97 граммами абсолютного спирта », — вы можно описать решения просто как 3% красителя в абсолютный алкоголь. Формула применима к любому
объем раствора, который может потребоваться. Три
грамм красителя плюс 97 грамм спирта будут окончательно
вес 100 грамм, поэтому краситель получается
3% от конечного веса.Обратите внимание, что окончательный вес
не обязательно равна окончательному объему. Формула применима к любому
объем раствора, который может потребоваться. Три
грамм красителя плюс 97 грамм спирта будут окончательно
вес 100 грамм, поэтому краситель получается
3% от конечного веса.Обратите внимание, что окончательный вес
не обязательно равна окончательному объему. Водные весовые растворы — самые простые
подготовить. Так как 1 миллилитр воды весит
один грамм, мы можем измерить объем вместо
взвешивание растворителя. Очень распространенное использование ж / б
формулы со средой для культивирования бактерий.
Такие среды бывают гранулированными или порошкообразными,
часто содержат агар и часто требуют тепла в
чтобы растворить компоненты.Микробиологический
среды, особенно если они содержат агар, являются
сложно перенести с одного судна на другое
не оставляя материала позади. Растворы по объему (вес / объем) Когда мы описываем концентрацию в процентах
без указания типа формулы подразумевается
что решение должно быть приготовлено с использованием объемной массы
(ж / в) метод. Как и в случае с массой, объемная масса равна
простой тип формулы для описания
приготовление раствора твердого материала
в жидком растворителе. Однопроцентный раствор определяется как 1 грамм
растворенного вещества на 100 миллилитров конечного объема. Например,
1 грамм хлорида натрия доведен до конечного объема
100 мл дистиллированной воды, представляет собой 1% раствор NaCl.
Чтобы помочь вспомнить определение 1% раствора,
помните, что один грамм — это масса одного миллилитра
воды. Объем / объем (об. / Об.) РастворовОбъем в объеме — еще один довольно простой способ описания решения. Мы просто описываем процент общего объема, внесенный жидкое растворенное вещество. Как и в случае с другими типами формул В биологии предполагается, что растворитель представляет собой воду, если не указан другой растворитель. V / v часто используется для описания спиртовых растворов.
которые используются для гистологии или для работы с
белки и нуклеиновые кислоты. Например, 70% этанол
просто 70 частей чистого этанола, смешанного с водой
сделать всего 100 частей. Обесцвечивание белковых гелей относится к замачиванию окрашенного геля в подкисленном спирте, чтобы удалить весь краситель, не связанный с белками, обнажая полосы. Полезный обесцвечивающий раствор состоит 7% метанола, 10% уксусной кислоты.Это означает использование, на литр конечного раствора, 100 мл чистого (или «ледяного») уксусная кислота и 70 мл метанола. МолярностьНедостаток описания формул как w / v (%) — в описании ничего не говорится о фактическая концентрация молекул в растворе. Что, если нам нужно равное количество двух химикатов
смешать вместе, чтобы для каждой молекулы
вещества №1 есть одна молекула
вещества №2? Такое же количество в граммах будет
вероятно, не содержат одинакового количества молекул
каждого вещества.Еще один недостаток
w / v метод заключается в том, что одно и то же химическое вещество может входить
много форм, так что такое же количество в граммах
одна форма химического вещества содержит другое количество
из этого, чем в другой форме. Например, вы можете работать
с химическим веществом, которое может быть в одной из нескольких форм
гидратации. Хлорид кальция может быть
приобретается в виде сухого химического вещества в безводной форме,
так что вы весите почти весь чистый кальций
хлористый.С другой стороны, у вас может быть запас
сухого химического вещества, которое гидратировано семью водой
молекул на молекулу хлорида кальция. Что, если нам нужно равное количество двух химикатов
смешать вместе, чтобы для каждой молекулы
вещества №1 есть одна молекула
вещества №2? Такое же количество в граммах будет
вероятно, не содержат одинакового количества молекул
каждого вещества.Еще один недостаток
w / v метод заключается в том, что одно и то же химическое вещество может входить
много форм, так что такое же количество в граммах
одна форма химического вещества содержит другое количество
из этого, чем в другой форме. Например, вы можете работать
с химическим веществом, которое может быть в одной из нескольких форм
гидратации. Хлорид кальция может быть
приобретается в виде сухого химического вещества в безводной форме,
так что вы весите почти весь чистый кальций
хлористый.С другой стороны, у вас может быть запас
сухого химического вещества, которое гидратировано семью водой
молекул на молекулу хлорида кальция.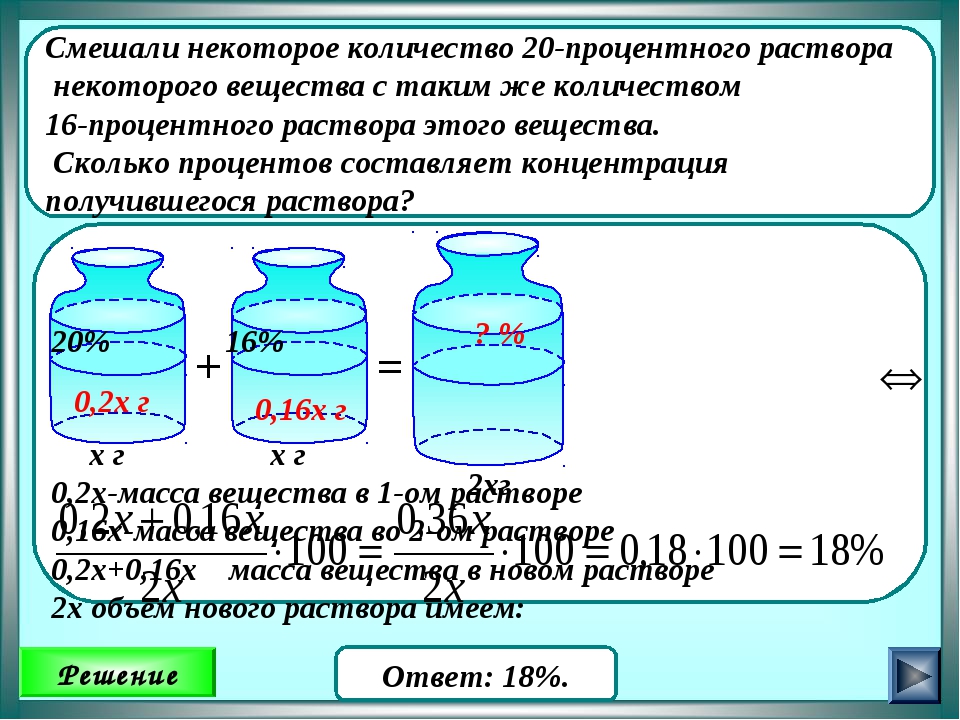 В
та же масса этого химического вещества будет содержать меньше молекул
хлорида кальция. В
та же масса этого химического вещества будет содержать меньше молекул
хлорида кальция.Когда нас интересуют актуальные концентрация молекул химического вещества в растворе, лучше универсальное измерение это работает независимо от того, как поставляется химикат.Пока молекулярная масса (иногда называемая формула веса) известна, мы можем описать решение в виде молей на литр или просто молярных (М). Работа с формульными весамиКак и в случае с w / v решениями, мы взвешиваем конкретную количество химиката при приготовлении молярного раствора. В отличие от в / в растворов, взвешиваемое количество зависит от от молекулярной массы (m.w.) вещества в граммах на моль (г / моль). Чтобы рассчитать желаемую массу растворенного вещества вам нужно будет знать формулу веса. Формула веса
обычно печатается на этикетке и идентифицируется
сокращенно f.w. Вес формулы
масса материала в граммах, содержащего
один моль вещества и может включать инертный
материалы и / или масса молекул воды
в случае гидратированных соединений.Для чистого
соединения формулы масса является молекулярной
вес вещества и может быть идентифицирован
как таковой. Формула веса
обычно печатается на этикетке и идентифицируется
сокращенно f.w. Вес формулы
масса материала в граммах, содержащего
один моль вещества и может включать инертный
материалы и / или масса молекул воды
в случае гидратированных соединений.Для чистого
соединения формулы масса является молекулярной
вес вещества и может быть идентифицирован
как таковой.Например, молекулярная масса хлорида кальция 111,0 грамма на моль (г / моль), что то же самое в качестве веса формулы, если материал безводный. Дигидрат хлорида кальция (CaCl2 • 2h3O) 147,0 г / моль. Для CaCl2 • 6h3O (гексагидрат) вес формулы 219.1 г / моль. Гидратированное соединение — это соединение, окруженное
молекулами воды, которые удерживаются водородом
облигации. Предположим, вам нужен один литр раствора 10 мМ хлорида кальция (10 ммоль, или 0,01 моль на литр), и предположим, что у вас есть только Дигидрат CaCl2. Чтобы приготовить раствор 10 мМ, вы отвести 1/100 веса формулы для дигидратированного CaCl2, что составляет 0,01 x 147,0 = 1,47 грамма и приносит это до одного литра. Осложнения с весами по формулеВозможно, вы не можете найти формулу веса на этикетка или, возможно, вы планируете протокол и не имеете под рукой настоящих химикатов. Вы можете рассчитать молекулярную массу из
химическая формула с помощью периодического
Таблица. Вы должны помнить, что когда вы
купить химикат формула вес может
не быть идентичным молекулярной массе. Предположим
что вы уже определили, сколько
взвешивать исходя из молекулярной массы, но
вес формулы больше из-за гидратации
или наличие инертного материала.Ваше лекарство
просто умножить расчетную массу
по соотношению формулы массы к молекулярной
вес (или просто пересчитайте необходимый вес). Вы можете рассчитать молекулярную массу из
химическая формула с помощью периодического
Таблица. Вы должны помнить, что когда вы
купить химикат формула вес может
не быть идентичным молекулярной массе. Предположим
что вы уже определили, сколько
взвешивать исходя из молекулярной массы, но
вес формулы больше из-за гидратации
или наличие инертного материала.Ваше лекарство
просто умножить расчетную массу
по соотношению формулы массы к молекулярной
вес (или просто пересчитайте необходимый вес). Например, предположим, что вам нужно 10 граммов
чистый CaCl2 (м.в. 111,0 г / моль), затем обнаружено
все, что у вас есть, это гексагидратированная форма (CaCl2 • 6h3O,
f.w. 219,1 г / моль). Возьмите 219,1 разделить на 111,0
и умножьте на 10. Вам нужно 19.7 граммов CaCl2 • 6h3O. Материалы не всегда доступны в 100% чистом виде.
форма. Описание на этикетке может указывать
что химическое вещество имеет чистоту> 99%. Такое часто бывает
случай с ферментами или другими белками, которые должны
быть очищенным из природных источников. Большинство из нас делают
не беспокойтесь о чистоте, если она выше 99%. Больше
точность может быть важна для химика-аналитика,
например, но редко требуется в биологических
Приложения.Если есть значительные примеси
или если вы настаиваете на максимальной точности,
затем рассчитайте необходимое количество материала
и разделите на дробь, представляющую чистоту
вещества. Например, если вам нужно 10 грамм
чистого вещества А, но то, что у вас есть, на 95% чистое,
затем разделите 10 граммов на 0,95, чтобы получить 10,5 граммов (примечание
что результат округлен до разумного
уровень точности). Большинство химикатов имеют тенденцию впитывать воду, если они не
сохраняются иссушенными, то есть в некоторой степени
гигроскопичны. Эту проблему не следует путать
с состоянием гидратации веществ, которые
относится к прямой ассоциации молекул воды
с молекулами вещества через водород
склеивание. Хлорид магния обычно используется в
биологические буферы и, как известно, гигроскопичны.Вес формулы не включает добавленную массу
воды, которая поглощается из атмосферы,
фактически количество загрязнения зависит от
как долго и при каких условиях химикат
был отложен, особенно в отношении влажности.
Обычно беспокоиться о воде непрактично
контент, так как его так сложно контролировать. Если
точность имеет решающее значение, тогда химикаты должны быть
поддерживается в условиях осушения или используется
непосредственно перед тем, как они смогут поглотить значительную
количество воды. |
Принятие простых решений и разбавлений
| просто разбавление | серийное разведение | VC = VC метод | молярные растворы | процент решения || молярный -% конверсии | концентрированные исходные растворы (X единиц) | нормальность — преобразование молярности
Рабочая Расчет концентрации
1. Простое разбавление (метод коэффициента разбавления на основе соотношений)
Простое разведение — раствор, в котором единицы объема интересующего жидкого материала объединены
с соответствующим объемом растворителя жидкости для достижения
желаемая концентрация.Коэффициент разбавления — это
общее количество единичных объемов, в которых будет растворен ваш материал.
Затем разбавленный материал необходимо тщательно перемешать для достижения
истинное разбавление. Например, разбавление 1: 5 (вербализуйте как
Разбавление «от 1 до 5») влечет за собой объединение 1 единицы объема
из растворенное вещество (разбавляемый материал) + 4 шт.
объемах растворителя среды (следовательно, 1 + 4 = 5
= коэффициент разбавления).Фактор разбавления часто выражается
используя экспоненты: 1: 5 будет 5e-1; 1: 100 будет 10e-2, а
скоро.
Например, разбавление 1: 5 (вербализуйте как
Разбавление «от 1 до 5») влечет за собой объединение 1 единицы объема
из растворенное вещество (разбавляемый материал) + 4 шт.
объемах растворителя среды (следовательно, 1 + 4 = 5
= коэффициент разбавления).Фактор разбавления часто выражается
используя экспоненты: 1: 5 будет 5e-1; 1: 100 будет 10e-2, а
скоро.
Пример 1: Замороженный концентрат апельсинового сока обычно разбавляют с 4 дополнительными банками холодной воды (разбавляющий растворитель), давая коэффициент разбавления 5, т.е. оранжевый концентрат представляет одна единица объема, к которой вы добавили еще 4 банки (та же единица объемы) воды.Итак, апельсиновый концентрат теперь распределяется через 5 единичных объемов. Это будет называться разбавлением 1: 5, и OJ теперь на 1/5 меньше, чем было изначально.
Так, при простом разбавлении добавить на одну единицу объема растворителя меньше чем желаемое значение коэффициента разбавления.
Пример 2: Предположим, вы должны приготовить 400 мл дезинфицирующего средства, требующего разведения 1: 8 из концентрированного маточный раствор с водой.Разделите необходимый объем на разведение коэффициент (400 мл / 8 = 50 мл) для определения объема единицы. В затем выполняется разведение в виде 50 мл концентрированного дезинфицирующего средства + 350 мл воды.
Верх стр.
2. Серийное разбавление
Серийное разведение — это просто серия
простых разведений, которые быстро увеличивают коэффициент разбавления
начиная с небольшого начального количества материала (т.е.э., бактериальный
культура, химикат, апельсиновый сок и др. ). Источник разведения
материал (растворенное вещество) на каждом этапе происходит из разбавленного материала
предыдущего этапа разбавления. При серийном разведении всего коэффициент разбавления в любой момент равен произведению индивидуальные коэффициенты разбавления на каждом этапе, предшествующем этому.
). Источник разведения
материал (растворенное вещество) на каждом этапе происходит из разбавленного материала
предыдущего этапа разбавления. При серийном разведении всего коэффициент разбавления в любой момент равен произведению индивидуальные коэффициенты разбавления на каждом этапе, предшествующем этому.
Пример: В типичном упражнении по микробиологии студенты выполнить трехэтапное серийное разведение 1: 100 бактериального культуры (см. рисунок ниже) в процессе количественной оценки количество жизнеспособных бактерий в культуре (см. рисунок ниже). Каждый шаг в этом примере использует общий объем 1 мл. Первый шаг объединяет 1 единицу объема бактериальной культуры (10 мкл) с 99 единицами объемы бульона (990 мкл) = разведение 1: 100.
На втором этапе одна единица объема разведения 1: 100 сочетается с 99 единиц объема бульона теперь дают общее разведение 1: 100×100. = 1: 10 000 разведение. Снова повторил (третий шаг) сумма разведение будет 1: 100х10 000 = 1: 1 000 000 общего разведения. Концентрация бактерий теперь в миллион раз меньше на , чем в исходном образце.
Верх стр.
3.Изготовление фиксированных объемов определенных концентраций из жидких реагентов:
V1C1 = V2C2 Метод
Очень часто вам нужно будет сделать особый
объем известной концентрации из исходных растворов, или, возможно,
из-за ограниченной доступности жидких материалов (некоторые химические вещества
очень дороги и продаются и используются в небольших количествах,
например, микрограммы) или ограничить количество химических отходов. Приведенная ниже формула представляет собой быстрый подход к расчету таких разбавлений.
где:
Приведенная ниже формула представляет собой быстрый подход к расчету таких разбавлений.
где:
Пример: Предположим, у вас есть 3 мл основного раствора ампициллина 100 мг / мл. (= C 1 ) и вы хотите сделать 200 мкл (= V 2 ) из раствор, имеющий 25 мг / мл (= C 2 ).Тебе следует знать какой объем ( V1 ) запаса для использования как часть необходимого общего объема 200 мкл.
V1 = объем запасов, с которого вы начнете. Это твое неизвестное.
C 1 = 100 мг / мл в исходном растворе
V 2 = общий объем, необходимый при новой концентрации = 200 мкл = 0,2 мл
C 2 = новая концентрация = 25 мг / мл
В алгебраической перестановке:
V1 = (V2 x C2) / C1
V1 = (0.
2 мл x 25 мг / мл) / 100 мг / мл
и после отмены ед.,
V1 = 0,05 мл или 50 мкл
Итак, вы должны взять 0,05 мл = 50 мкл основного раствора и разбавьте его 150 мкл растворителя до получить 200 ул
Необходим раствор 25 мг / мл. Помните, что количество растворителя используется зависит от окончательного необходимого объема, поэтому вам нужно вычесть начальный объем формируют окончательный для его расчета.
Верх стр.
4. Моли и молярные растворы (единица = M = моль / л)
Иногда может быть более эффективным использовать молярность при выражении химических концентраций. моль определяется как точно 6,023 x 1023 атомов или молекул вещества (это называется Avagadro’s number , N). Масса одного моля элемента равна его атомной массе (г) и указывается для каждого элемента в периодической таблице. Молекулярная масса — это масса (г) вещества, основанная на суммированных атомных массах элементов в химической формуле. Вес формулы относится к химическим веществам, для которых не существует отдельных молекул; например, NaCl в твердой форме состоит из ионов Na + и Cl-, но настоящих молекул NaCl не существует. Формула вес 1 моля NaCl, следовательно, будет суммой 1 атомной массы каждого иона. Молекулярная масса (или FW) указывается на этикетке бутылки с химическим веществом.Количество молей в произвольной массе элемента или соединения можно рассчитать как:
Масса одного моля элемента равна его атомной массе (г) и указывается для каждого элемента в периодической таблице. Молекулярная масса — это масса (г) вещества, основанная на суммированных атомных массах элементов в химической формуле. Вес формулы относится к химическим веществам, для которых не существует отдельных молекул; например, NaCl в твердой форме состоит из ионов Na + и Cl-, но настоящих молекул NaCl не существует. Формула вес 1 моля NaCl, следовательно, будет суммой 1 атомной массы каждого иона. Молекулярная масса (или FW) указывается на этикетке бутылки с химическим веществом.Количество молей в произвольной массе элемента или соединения можно рассчитать как:
число молей = вес (г) / атомный (или молекулярный) вес (г)
Молярность (М) — это единица, используемая для описания количества молей элемента или соединения в одном литре (л) раствора (M = моль / л) и, следовательно, единица измерения концентрации. Согласно этому определению 1,0 М раствор эквивалентен одной молекулярной массе (г / моль) соединения, доведенной до 1 литра (1.0 л) объема с растворителем (например, водой) при фиксированной температуре (жидкости расширяются и сжимаются с температурой и, таким образом, могут изменять молярность).
Согласно этому определению 1,0 М раствор эквивалентен одной молекулярной массе (г / моль) соединения, доведенной до 1 литра (1.0 л) объема с растворителем (например, водой) при фиксированной температуре (жидкости расширяются и сжимаются с температурой и, таким образом, могут изменять молярность).
Пример 1: Для приготовления литра молярного раствора из сухого реагента
Умножьте молекулярную массу (или FW) на желаемую молярность, чтобы определить, сколько граммов реагента использовать:
Предположим, что молекулярная масса соединения = 194,3 г / моль;
, чтобы получилось 0.15 М раствор использовать 194,3 г / моль * 0,15 моль / л = 29,145 г / л
Вы должны растворить указанную массу реагента во фракции общего объема растворителя (в стандартном режиме), а затем увеличить объем ровно до одного литра, добавив дополнительный растворитель и тщательно перемешав.
Пример 2 : Для приготовления определенного объема определенного молярного раствора из сухого реагента
Химический продукт имеет FW 180 г / моль, а вам нужно 25 мл (0.025 л) 0,15 М раствора (М = моль / л). Сколько граммов химического вещества нужно для приготовления этого раствора?
# грамм / желаемый объем (л) = желаемая молярность (моль / л) * FW (г / моль)
путем алгебраической перестановки,
# граммы = желаемый объем (л) * желаемая молярность (моль / л) * FW (г / моль) # граммы = 0,025 л * 0,15 моль / л * 180 г / моль
после списания единиц,
#grams = 0.675 г
Итак, вам нужно 0,675 г / 25 мл
Растворы, содержащие несколько реагентов
Сложные растворы, такие как буферы, физиологические растворы, фиксаторы и т. Д., Могут состоять из нескольких химических реагентов. При приготовлении этих растворов каждый реагент рассматривается отдельно, чтобы определить, сколько использовать для приготовления окончательного раствора. Для каждого из них объем, использованный в расчетах, является окончательным необходимым объемом раствора.
Д., Могут состоять из нескольких химических реагентов. При приготовлении этих растворов каждый реагент рассматривается отдельно, чтобы определить, сколько использовать для приготовления окончательного раствора. Для каждого из них объем, использованный в расчетах, является окончательным необходимым объемом раствора.
Еще примеры решенных проблем: About.com: Химия
Верх
страницы
5. Процентные растворы (% = доли на сто или грамм / 100 мл)
Многие реагенты смешиваются в виде -процентных растворов либо по массе на объем (мас. / Об.) При запуске с сухими реагентами ИЛИ объем на объем (об. / Об.) При запуске с жидкими реагентами . При приготовлении растворов из сухих реагентов для получения заданной процентной концентрации используется одна и та же масса любого реагента, хотя молярные концентрации будут разными.
В целом
Массовый процент (мас. / Об.) = [масса растворенного вещества (г) / объем раствора (мл)] x 100, и,
Объемный процент (об. / Об.) = [объем растворенного вещества (мл) / объем раствора (мл)] x 100
Например, 100 мл 10% раствора любого сухого реагента будет содержать 10 г сухого реагента в конечном объеме 100 мл.10% (об. / Об.) Раствор должен содержать 10 мл растворенного вещества / 100 мл объема раствора.
Пример 1: Если вы хотите получить 200 мл 3% NaCl, вы должны необходимо 0,03 г / мл x 200 мл = 6,0 г NaCl в 200 мл воды.
При использовании жидких реагентов процентная концентрация основана на объема на объем , и рассчитывается аналогично как концентрация % x необходимый объем = объем используемого реагента .
Пример 2: Если вы хотите сделать 2 л 70% этанола из 100% этанола, вы должны смешать 0,70 мл / мл x 2000 мл = 1400 мл этанола с 600 мл воды.
Чтобы преобразовать% раствора в молярность , умножьте% раствора на 10, чтобы выразить процент раствора, грамм / л, затем разделите на вес формулы.
Молярность = (граммы реагента / 100 мл) * 10xxxxxxxxxx FW
Пример 1: Преобразование 6.5% раствор химического вещества с FW = 325,6 к молярности,
[(6,5 г / 100 мл) * 10] / 325,6 г / моль = [65 г / л] / 325,6 г / моль = 0,1996 M
Преобразовать из молярности к процентному раствору , умножьте молярность на FW и разделите на 10:
% раствор = молярность * FWxxxxxxxxxx10
Пример 2: Преобразование 0.
[0,0045 моль / л * 178,7 г / моль] / 10 = 0,08 % раствор0045 М раствор химическое вещество, имеющее FW 178,7 к процентному раствору:
Верх стр.
6. Концентрированный стоковые растворы — в единицах «X»
Стандартные растворы стабильной соединения обычно поддерживаются в лабораториях как более концентрированные растворы, которые могут быть разбавлены до рабочей прочности при использовании в Типичные области применения.Обычная рабочая концентрация обозначается как 1x. Раствор в 20 раз более концентрированный будет обозначен как 20x и потребуется разбавление 1:20 для восстановления типичного рабочая концентрация.
Пример: 1x раствор соединения имеет молярную концентрацию 0,05 M для его типичного использования в лабораторных условиях.
Приклад 20x будет приготовлен в концентрации 20 * 0,05 М = 1.0 М. А Приклад 30X составит 30 * 0,05 M = 1,5 млн.
7. Нормальность (N): преобразование в молярность
Нормальность = n * M, где n = количество протонов (H +) в молекуле кислоты.
Пример: В формуле концентрированной серной (36 N h3SO4) протонов два, поэтому его молярность = N / 2. Итак, 36N h3SO4 = 36/2 = 18 М.
Модифицированный 9-27-12 ga
Биологический факультет Колледжа Бейтса, Льюистон, ME 04240
Химический, молярный и массовый процент
Растворы представляют собой однородные (равномерно распределенные) смеси двух или более химических веществ. Растворы могут существовать в виде твердых тел, жидкостей или газов.
Все растворы содержат растворитель и одно или несколько растворенных веществ. Растворитель, часто вода, является наиболее распространенным химическим веществом.Растворенное вещество — это менее распространенные химические вещества.
Решения для создания
Как растворять твердые частицы и уменьшать масштабы экспериментов
Для экспериментов вам часто нужно растворять растворенные вещества в твердой форме, чтобы получить растворы определенной силы (сила измеряется по диссоциации ионов). Запланируйте один час на каждые 2-4 раствора, которые вам нужно приготовить. Вам потребуются весы для взвешивания растворенного вещества и градуированный цилиндр для измерения растворителя (если это вода).
Во-первых, определите концентрацию (массовый процент или молярность, см. Ниже) и количество (миллилитры) раствора, которое вам нужно, исходя из лабораторной процедуры. Во-вторых, рассчитайте необходимое количество растворенного вещества в граммах, используя одну из формул, приведенных ниже. Затем взвесьте растворенное вещество и добавьте его в стакан для смешивания. Наконец, с помощью градуированного цилиндра измерьте необходимый объем воды в миллилитрах и добавьте его в стакан. Размешивайте раствор, пока все химическое вещество не растворится.
Затем взвесьте растворенное вещество и добавьте его в стакан для смешивания. Наконец, с помощью градуированного цилиндра измерьте необходимый объем воды в миллилитрах и добавьте его в стакан. Размешивайте раствор, пока все химическое вещество не растворится.
Разбейте твердые куски химиката ступкой и пестиком или осторожно раздавив молотком в полиэтиленовом пакете.Химические вещества растворяются быстрее при осторожном нагревании раствора и перемешивании.
Вы можете рассмотреть возможность уменьшения масштаба, когда эксперименты требуют большого количества химикатов. Уменьшение масштаба снижает угрозы безопасности, химические затраты и удаление отходов.
Большинство экспериментов можно уменьшить, разделив растворенное вещество и растворитель на коэффициент по вашему выбору. Например, эксперимент, требующий 50 г растворителя и 250 мл воды, можно уменьшить в 10 раз, чтобы использовать только 5 г растворителя и 25 мл воды.Вы можете упростить масштабирование, используя мензурки, пробирки и другое измерительное оборудование меньшего размера.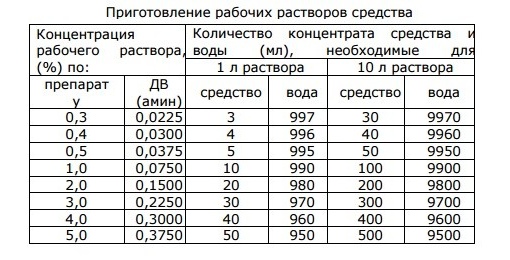
При приготовлении химических растворов всегда используйте соответствующее защитное оборудование.
Как приготовить молярные растворы
Молярные (М) растворы основаны на количестве молей химического вещества в одном литре раствора. Моль состоит из 6,02 × 10 23 молекул или атомов. Молекулярный вес (MW) — это вес одного моля химического вещества. Определите молекулярную массу, используя периодическую таблицу, добавив атомную массу каждого атома в химическую формулу.
Пример: Для получения молекулярной массы CaCl 2 добавьте атомную массу Ca (40,01) к атомной массе двух Cl (2 x 35,45), чтобы получить 110,91 г / моль. Следовательно, 1M раствор CaCl 2 состоит из 110,91 г CaCl 2 , растворенных в воде, достаточной для приготовления одного литра раствора.
После того, как молекулярная масса растворенного вещества известна, масса химического вещества, которое должно раствориться в растворе для молярного раствора менее 1M, рассчитывается по формуле:
- грамм химического вещества = (молярность раствора в моль / литр) x (молекулярная масса химического вещества в г / моль) x (мл раствора) ÷ 1000 мл / литр
Например, чтобы сделать 100 мл 0. 1 M раствор CaCl 2 , используйте предыдущую формулу, чтобы узнать, сколько CaCl 2 вам нужно:
1 M раствор CaCl 2 , используйте предыдущую формулу, чтобы узнать, сколько CaCl 2 вам нужно:
- грамм CaCl 2 = (0,1) x (110,91) x (100) ÷ (1000) = 1,11 г
Теперь вы можете приготовить свой раствор: растворите 1,11 г CaCl 2 в воде, достаточной для получения 100 мл раствора. Необходимое количество воды будет чуть меньше 100 мл.
Для приготовления молярных растворов используются весы и мерная колба. Процедура приготовления молярного раствора с использованием мерной колбы на 100 мл следующая:
- Рассчитайте массу растворенного вещества, необходимую для приготовления 100 мл раствора, используя приведенную выше формулу.
- Взвесьте необходимое количество растворенного вещества на весах.
- Перенесите растворенное вещество в чистую сухую мерную колбу на 100 мл.
- Медленно добавьте дистиллированную воду в мерную колбу. При этом промойте все растворенное вещество на дне колбы.
 Продолжайте добавлять воду, пока не дойдете до отметки 100 мл на горлышке колбы.
Продолжайте добавлять воду, пока не дойдете до отметки 100 мл на горлышке колбы. - Поместите пробку в колбу и осторожно покрутите колбу, пока все растворенное вещество не растворится.
Если у вас нет мерной колбы, вы можете использовать мерный цилиндр на 100 мл.Просто добавьте растворенное вещество в градуированный цилиндр, а затем добавьте дистиллированную воду до отметки 100 мл на боковой стороне цилиндра.
Как приготовить растворы в процентах по массе
В растворах массовых процентов вес растворенного вещества делится на вес раствора (растворенное вещество + вода) и умножается на 100. Поскольку плотность воды составляет 1 г / мл, формула для расчета количества растворенного вещества, которое должно смешать для получения массового процента раствора составляет:
- грамм растворенного вещества = (вес.% Раствора) x (мл воды) ÷ (100 — вес.% Раствор)
В качестве примера, чтобы приготовить 100 мл 10% раствора NaCl (поваренной соли), используйте предыдущую формулу, чтобы узнать, сколько NaCl вам нужно:
- грамм NaCl = (10) x (100) ÷ (100-10) = 11.
 1 г
1 г
Теперь вы можете приготовить свой раствор: растворите 11,1 г NaCl в 100 мл воды.
Создайте собственное решение для этих проектов:
Frozen Bubbles
Радужная реакция
Биологический тест на токсичность
Гальваника: ключ с медным покрытием
процентов решений | Химия для неосновных
Цели обучения
- Определите концентрацию.
- Выполните вычисления с использованием растворов в процентах по массе и по объему.
Сколько — это много?
Есть культуры, у которых нет числа больше трех. Все, что больше, просто называется «много» или «много». Мы понимаем, насколько ограничена эта форма расчетов, но делаем то же самое. Есть несколько способов количественно выразить количество растворенного вещества в растворе. Концентрация раствора является мерой количества растворенного вещества, растворенного в данном количестве растворителя или раствора. Концентрированный раствор — это раствор, содержащий относительно большое количество растворенного вещества. Разбавленный раствор — это раствор, содержащий относительно небольшое количество растворенного вещества. Однако эти термины расплывчаты, и нам нужно уметь выражать концентрацию с помощью чисел.
Концентрированный раствор — это раствор, содержащий относительно большое количество растворенного вещества. Разбавленный раствор — это раствор, содержащий относительно небольшое количество растворенного вещества. Однако эти термины расплывчаты, и нам нужно уметь выражать концентрацию с помощью чисел.
Процентные решения
Одним из способов описания концентрации раствора является процент растворенного вещества в растворителе. Далее процентное содержание можно определить одним из двух способов: (1) отношением массы растворенного вещества к массе раствора или (2) отношением объема растворенного вещества к объему раствора.
Массовый процент
Когда растворенное вещество в растворе представляет собой твердое вещество, удобный способ выразить концентрацию — это массовый процент, который представляет собой граммы растворенного вещества на 100 г раствора.
Предположим, что раствор был приготовлен путем растворения 25,0 г сахара в 100 г воды. Массовый процент рассчитывается следующим образом:
Массовый процент рассчитывается следующим образом:
Иногда вам может понадобиться приготовить определенную массу раствора с заданным процентом по массе и нужно рассчитать, какую массу использовать растворитель.Например, вам нужно сделать 3000 г 5% раствора хлорида натрия. Вы можете переставить и вычислить массу растворенного вещества.
Вам нужно взвесить 150 г NaCl и добавить его в 2850 г воды. Обратите внимание, что необходимо было вычесть массу NaCl (150 г) из массы раствора (3000 г), чтобы рассчитать массу воды, которую необходимо было добавить.
Объем в процентах
Процент растворенного вещества в растворе легче определить по объему, если растворенное вещество и растворитель являются жидкостями.Объем растворенного вещества, деленный на объем раствора, выраженный в процентах, дает процент по объему раствора. Если раствор приготовлен путем добавления 40 мл этанола к 20 мл воды, объемный процент составляет:
Часто на этикетках ингредиентов на пищевых продуктах и лекарствах суммы указаны в процентах (см. Рисунок ниже).
Рисунок ниже).
Сводка
- Описываются методы расчета массовых и объемных процентных концентраций раствора.
Практика
Прочтите страницы 1-3 материала по указанной ниже ссылке и решите проблемы, связанные с этим разделом. Решите проблемы, прежде чем проверять ответы.
http://go.hrw.com/resources/go_sc/mc/HUGPS163.PDF
Обзор
- Почему термины «концентрированный» и «разбавленный» не очень полезны?
- Когда бы вы использовали расчет объемных процентов?
- Почему вы вычитаете массу растворенного вещества из желаемой общей массы при вычислении массовых процентов?
Глоссарий
- концентрированный: Раствор, содержащий относительно большое количество растворенного вещества.
- концентрация: Мера количества растворенного вещества, растворенного в данном количестве растворителя или раствора.
- разбавленный: Раствор, содержащий относительно небольшое количество растворенного вещества.

Расчет количества растворенных веществ для процентных растворов
В гистологической лаборатории часто требуется вычисление количества растворенного вещества, необходимого для конкретного раствора. Можно использовать следующее соотношение:
% желаемого / 100 мл = г или мл необходимого / желаемого объема
Пример 1:
Для стадии обесцвечивания Ziehl необходимо приготовление 1% спиртового раствора. -Метод Нильсена.Литр раствора обычно делается из концентрированной HCl и 70% спирта. Сколько миллилитров концентрированной HCl нужно для приготовления 1 литра 1% спиртового раствора?
(помните, 1 л = 1000 мл)
1/100 мл = X мл / 1000 мл
Перекрестное умножение,
1 x 1000 = 100 X
X = 10 мл концентрированный HCl
Пример 2:
Гистологу необходимо приготовить 500 мл 29% раствора хлорида железа. Рассчитайте необходимое количество растворенного вещества.
Рассчитайте необходимое количество растворенного вещества.
29/100 = X г / 500 мл
Перекрестное умножение,
29 x 500 = 100 X
X = 145 г хлорида железа
Пример 3:
A 0,55% раствор метабисульфита калия необходим для метода периодической кислотной окраски Шиффа (PAS). Гистологу необходимо приготовить 400 мл раствора. Сколько граммов метабисульфита калия понадобится?
0.55/100 = X г / 400 мл
Перекрестное умножение,
0,55 X 400 = 100 X
X = 2,2 г метабисульфита калия
Вы также можете посмотреть этот % w / v проблема таким образом :
0,55% раствор метабисульфита калия содержит по определению 0,55 г растворенного вещества в 100 мл.
Гистологу необходимо приготовить 400 мл этого процентного раствора или в 4 раза больше этого 0.


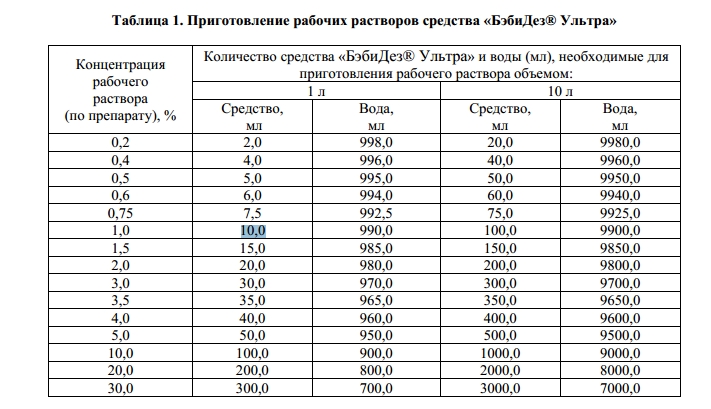
 Обычно можно предположить, что
раствор должен быть водным, если не указано иное.
А как насчет концентрации вещества до
быть добавленным? Распространенные способы описания концентраций
решений весовые, объемные,
объемный объем и молярность. Реже
используемые описания включают нормальность и молярность.
У всех этих формул есть одна общая черта. А
количество растворенного вещества отмеряется, смешивается с
растворителем, и объем доводится до некоторой конечной
количество после полного растворения растворенного вещества.То есть растворы обычно готовят объемным способом.
Поскольку растворенные вещества добавляют объем к количеству растворителя,
такой способ приготовления растворов необходим
чтобы обеспечить точную желаемую концентрацию
получено.
Обычно можно предположить, что
раствор должен быть водным, если не указано иное.
А как насчет концентрации вещества до
быть добавленным? Распространенные способы описания концентраций
решений весовые, объемные,
объемный объем и молярность. Реже
используемые описания включают нормальность и молярность.
У всех этих формул есть одна общая черта. А
количество растворенного вещества отмеряется, смешивается с
растворителем, и объем доводится до некоторой конечной
количество после полного растворения растворенного вещества.То есть растворы обычно готовят объемным способом.
Поскольку растворенные вещества добавляют объем к количеству растворителя,
такой способ приготовления растворов необходим
чтобы обеспечить точную желаемую концентрацию
получено. Например,
питательные среды для бактерий обычно изготавливаются
вверх, добавив отмеренное количество порошка
от среднего до отмеренного объема воды.В таком
случаях не важно, чтобы точная концентрация
быть получен, таким образом, метод измерения веса к объему
уместно, а не по объему.
Например,
питательные среды для бактерий обычно изготавливаются
вверх, добавив отмеренное количество порошка
от среднего до отмеренного объема воды.В таком
случаях не важно, чтобы точная концентрация
быть получен, таким образом, метод измерения веса к объему
уместно, а не по объему. Они покрывают
поверхности стеклянной посуды, создавая беспорядок. С помощью
по массе смесь среды и воды можно смешивать,
нагревают, а затем стерилизуют — все в одном контейнере.
Например, триптический соевый агар, очень богатая среда
используется для выращивания различных видов бактерий,
поставляется с инструкциями по смешиванию 40 грамм
агар с одним литром (эквивалент 1 килограмму)
деионизированной воды, без корректировки конечной
объем.Очень мало материала тратится зря.
меньше беспорядка.
Они покрывают
поверхности стеклянной посуды, создавая беспорядок. С помощью
по массе смесь среды и воды можно смешивать,
нагревают, а затем стерилизуют — все в одном контейнере.
Например, триптический соевый агар, очень богатая среда
используется для выращивания различных видов бактерий,
поставляется с инструкциями по смешиванию 40 грамм
агар с одним литром (эквивалент 1 килограмму)
деионизированной воды, без корректировки конечной
объем.Очень мало материала тратится зря.
меньше беспорядка. Этот метод можно использовать
для описания любого решения, но обычно используется
для простых физиологических растворов и когда формула
вес растворенного вещества неизвестен, переменный,
или нерелевантно, что часто бывает с
сложные красители, ферменты или другие белки. Решения
которые требуют материалов из природных источников
часто готовят в / в, потому что молекулярная формула
вещества неизвестно и / или потому что
вещество нельзя описать ни одним
формула.
Этот метод можно использовать
для описания любого решения, но обычно используется
для простых физиологических растворов и когда формула
вес растворенного вещества неизвестен, переменный,
или нерелевантно, что часто бывает с
сложные красители, ферменты или другие белки. Решения
которые требуют материалов из природных источников
часто готовят в / в, потому что молекулярная формула
вещества неизвестно и / или потому что
вещество нельзя описать ни одним
формула. Масса растворенного вещества, необходимая для
для приготовления 1% раствора — 1% от массы
чистая вода желаемого конечного объема.Примеры
100% растворов составляют 1000 грамм на 1000 миллилитров
или 1 грамм в 1 миллилитре.
Масса растворенного вещества, необходимая для
для приготовления 1% раствора — 1% от массы
чистая вода желаемого конечного объема.Примеры
100% растворов составляют 1000 грамм на 1000 миллилитров
или 1 грамм в 1 миллилитре. Сделать литр такой
раствор мы бы начали с 0,7 л абсолютного этанола
и довести водой до 1 литра.
Чаще бывает 95% алкоголя.Чтобы приготовить 70% раствор из 95% основного раствора
требует немного большего расчета. Мы поговорим
об этом чуть позже, когда мы обсудим, как сделать
разведения.
Сделать литр такой
раствор мы бы начали с 0,7 л абсолютного этанола
и довести водой до 1 литра.
Чаще бывает 95% алкоголя.Чтобы приготовить 70% раствор из 95% основного раствора
требует немного большего расчета. Мы поговорим
об этом чуть позже, когда мы обсудим, как сделать
разведения. Молекулы воды в гидратированном соединении
стать частью решения, когда материал
растворяется. Таким образом, 111,0 грамма безводного CaCl2,
147,0 грамма дигидратированного CaCl2 или 219,1 грамма
гексагидрата CaCl2 в одном литре конечного объема
все дают 1 моль на литр раствора, сокращенно
1М.
Молекулы воды в гидратированном соединении
стать частью решения, когда материал
растворяется. Таким образом, 111,0 грамма безводного CaCl2,
147,0 грамма дигидратированного CaCl2 или 219,1 грамма
гексагидрата CaCl2 в одном литре конечного объема
все дают 1 моль на литр раствора, сокращенно
1М.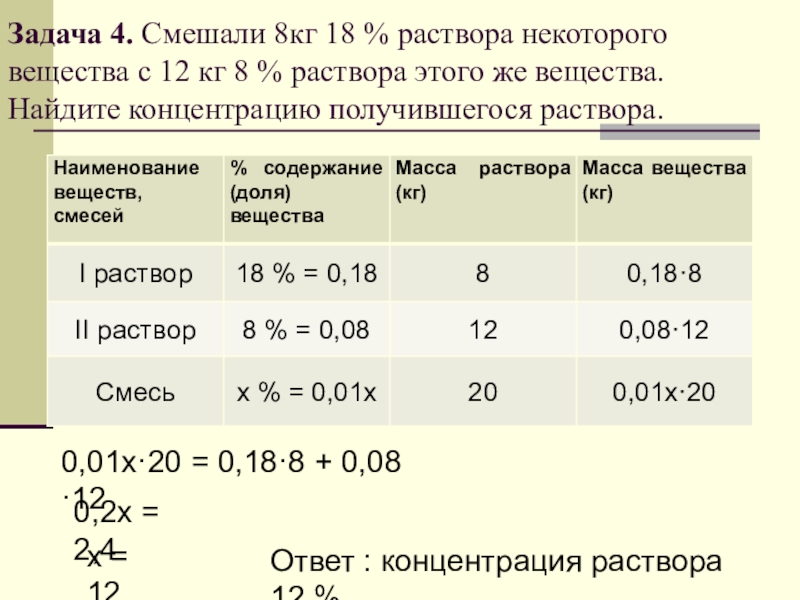


 Так,
при простом разбавлении добавить на одну единицу объема растворителя меньше чем желаемое значение коэффициента разбавления.
Так,
при простом разбавлении добавить на одну единицу объема растворителя меньше чем желаемое значение коэффициента разбавления. На втором этапе
одна единица объема разведения 1: 100 сочетается с
99 единиц объема бульона теперь дают общее разведение 1: 100×100.
= 1: 10 000 разведение. Снова повторил (третий шаг) сумма
разведение будет 1: 100х10 000 = 1: 1 000 000 общего разведения.
Концентрация бактерий теперь в миллион раз меньше на , чем в исходном образце.
На втором этапе
одна единица объема разведения 1: 100 сочетается с
99 единиц объема бульона теперь дают общее разведение 1: 100×100.
= 1: 10 000 разведение. Снова повторил (третий шаг) сумма
разведение будет 1: 100х10 000 = 1: 1 000 000 общего разведения.
Концентрация бактерий теперь в миллион раз меньше на , чем в исходном образце. 2
мл x 25 мг / мл) / 100 мг / мл
2
мл x 25 мг / мл) / 100 мг / мл 
 0045 М раствор
химическое вещество, имеющее FW 178,7 к процентному раствору:
0045 М раствор
химическое вещество, имеющее FW 178,7 к процентному раствору: Приклад 20x
будет приготовлен в концентрации 20 * 0,05 М = 1.0 М. А
Приклад 30X составит 30 * 0,05 M = 1,5 млн.
Приклад 20x
будет приготовлен в концентрации 20 * 0,05 М = 1.0 М. А
Приклад 30X составит 30 * 0,05 M = 1,5 млн. Продолжайте добавлять воду, пока не дойдете до отметки 100 мл на горлышке колбы.
Продолжайте добавлять воду, пока не дойдете до отметки 100 мл на горлышке колбы. 1 г
1 г